Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
川口也和子さん、日本進化学会で口頭発表最優秀賞
国立遺伝学研究所・分子生命史研究室(工樂研究室)博士研究員の川口也和子さんが2025年8月20日~23日、長浜バイオ大学(滋賀県長浜市)で開催された日本進化学会第27回大会で、「口頭発表賞 最優秀賞」を受賞しました。
川口也和子さんは、2023年度に国立遺伝学研究所 博士研究員に採用され、活躍しております。
▶ 受賞発表タイトル:脊椎動物におけるゲノム構造進化の動態

川口也和子さん
ゲノム構造変異とリピート変異を配列識別して高精度に検出するソフトウェアTRsvを開発
プレスリリース
TRsv: simultaneous detection of tandem repeat variations, structural variations, and short indels using long read sequencing data.
Shunichi Kosugi, Chikashi Terao
Genome Biology 26, Article number: 246 (2025) DOI:10.1186/s13059-025-03718-z
個人間のゲノム配列の違いは、病気の罹りやすさを含めた様々な形質の違いを表しています。配列の違いを生み出すものの中で繰り返し変異(繰り返し配列のコピー数変異)は神経筋疾患や量的形質の要因となり、構造変異・インデル(欠失や挿入など)は神経発達障害や癌などの疾患要因となっています。しかし、これらを正確に区別して検出する解析手法はこれまでに存在しませんでした。
本研究では、ロングリードデータを用いて繰り返し変異と構造変異・インデルを配列識別によって正確に区別して同定するソフトウェア(TRsv)を開発しました。TRsvは既存のツールと比較してより高い繰り返し変異検出精度・感度を示し、繰り返し変異と構造変異をより高い精度で識別しました。さらに、160人のロングリード全ゲノムシーケンスデータを用いた解析において、TRsvは遺伝子発現、疾患、量的形質に関連する繰り返し変異を実際に検出できることを証明しました。今後ロングリードの活用が増す中で、TRsvはゲノムの繰り返し変異、構造変異・インデルを検出するツールとして広く活用されることが期待されます。
本成果は、情報・システム研究機構国立遺伝学研究所、同機構データサイエンス共同利用基盤施設、静岡県立総合病院、理化学研究所によるものです。
情報・システム研究機構国立遺伝学研究所 同機構先端ゲノミクス推進センター 特任准教授、データサイエンス共同利用基盤施設 ゲノムデータ解析支援センター 特任准教授および静岡県立総合病院 研究員 (研究当時)の小杉俊一と、 静岡県立総合病院 免疫研究部長、理化学研究所 生命医科学研究センター ゲノム解析応用研究 チームリーダーの寺尾知可史との共同研究成果です。
本研究は、日本学術振興会(JSPS)科研費(JP17K07264, JP21K06130)の支援を受け行われたものです。
本研究成果は、国際科学雑誌「Genome Biology」に2025年8月20日(日本時間)に掲載されました。
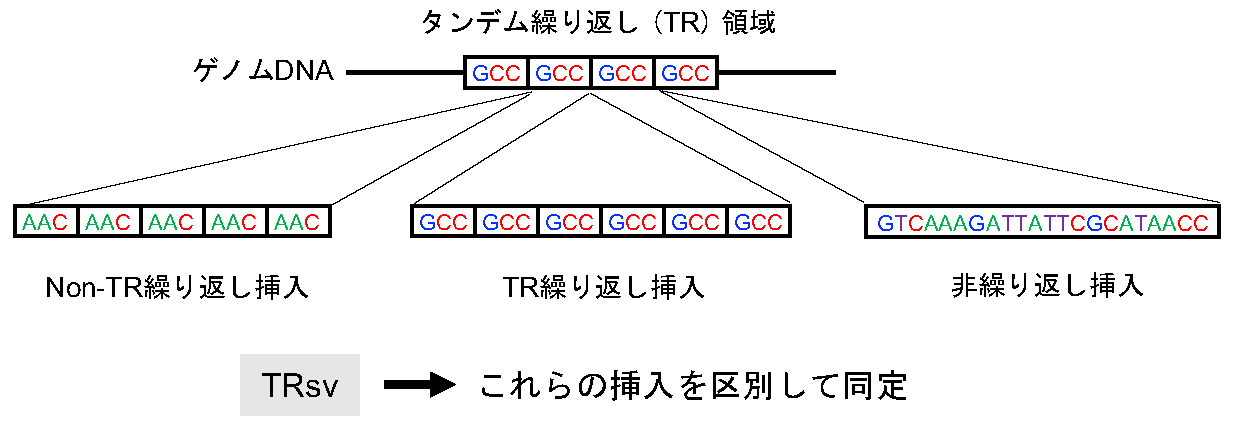
図1: TRsvはタンデム繰り返し領域で観察される異なるタイプの挿入を検出する
タンデム繰り返し(TR)領域内では、TR領域の繰り返し単位(図の例ではGCC)と同じ繰り返し単位からなるTR繰り返し挿入が観察されることが多いが、異なる繰り返し単位からなる挿入(Non-TR繰り返し挿入)や、繰り返しを持たない挿入(非繰り返し挿入)がしばしば観察される。TRsvは、これらの異なるタイプの挿入を区別して同定する。
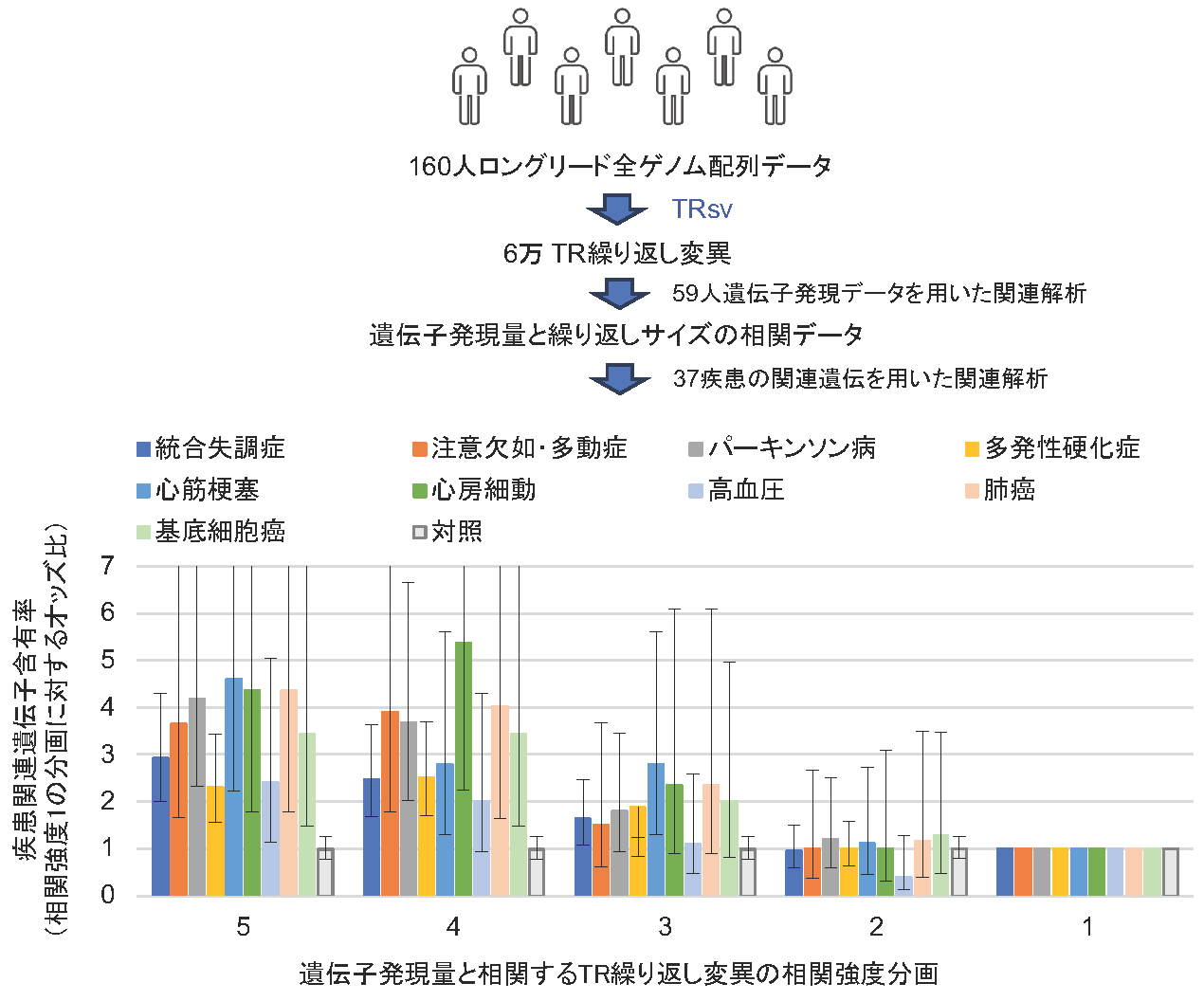
図2: 疾患関連遺伝子とTR繰り返し変異の関連がTRsvを用いて明らかにされた
160人のロングリード全ゲノム配列データからTRsvを用いて検出された6万個のTR繰り返し変異、および対応する59人分の遺伝子発現データを用いて、遺伝子発現量とTR繰り返し変異のサイズの相関が調べられた。その相関強度が強い順に5から1まで相関遺伝子セットを5等分に分画した(横軸)。各分画に含まれる疾患関連遺伝子の割合が計算され、相関強度1の分画の疾患関連遺伝子含有率に対する各分画の含有率の比(オッズ比)が各疾患毎にプロットされた(縦軸)。対照として、ヒト2万遺伝子から無作為に選別された800遺伝子セットのオッズ比が示される。バー上の黒線は標準誤差を示す。この結果は、多くの疾患に関わる遺伝子の発現がTR繰り返し変異によって制御されることを示すと共に、疾患の発症がTR繰り返し変異によって影響を受けることを示唆している。
エイの淡水適応を支える驚異の腎機能
日本人とサウジアラビア人のゲノム情報を反映した新しい「ゲノム地図」を作成
タンパク質急速除去が見出した、子どもの脳の発達の「新たな臨界期」
プレスリリース
Inducible NMDA Receptor Knockdown Reveals a Maintenance Phase in Dendritic Refinement of Barrel Cortex Neurons
Ayane Nihashi, Naoki Nakagawa, Takuya Sato, Mariko Yamamoto, Luwei Wang, Rieko Ajima, Yumiko Saga, Yumiko Yoshimura, Masato T. Kanemaki, Takuji Iwasato*
*責任著者
iScience (2025) DOI:10.1016/j.isci.2025.113229
生まれたばかりの赤ん坊の脳では神経回路は未完成であり、「臨界期」と呼ばれる子どもの特定の時期に受けた刺激に応じて洗練されることにより、おとなの複雑な行動を支える精緻な回路が完成します。子ども期の脳神経回路の洗練に必要な分子(機能タンパク質)は色々見つかっていますが、それらが「いつ」どのように働くのかは、有効な技術が無かったため、まったくわかっていませんでした。
国立遺伝学研究所(遺伝研)神経回路構築研究室の二橋彩音 総合研究大学院大学(総研大)大学院生(SOKENDAI特別研究員、日本学術振興会特別研究員DC2)と岩里琢治教授らの研究グループは、遺伝研の鐘巻将人教授、相賀裕美子教授、生理学研究所の吉村由美子教授らと共同で、新技術AID2法を適用することにより、生きた新生仔マウスの脳の中で、目的の分子を任意のタイミングで素早く消失させることに成功しました。次いで、子どもの脳の神経回路構築で鍵となる役割が期待された分子NMDA型グルタミン酸受容体(NMDAR)を、回路の洗練が進行する生後3~6日に消失させると、神経回路が正確に構築されなくなることを見つけました。このことにより、子ども特有の回路構築の「現場」でNMDARが実際に働いていることが示されました。さらに重要なことに、回路の洗練がほぼ終了して正確な回路が既に形成されたように見える生後6~9日にNMDARを消失させると、あたかも最初からNMDARが無かったかのような不正確な回路へと急激に変化しました。一方、生後12日からNMDARを消失させても何も起きませんでした。これらのことから、神経回路は、洗練される過程(=従来の臨界期)だけでなく、その後もしばらく不安定であり(=新たな臨界期)、その間、NMDARによって強力に維持される必要があることがわかりました。
本研究では、急速タンパク質分解を可能とする新技術AID2法を用いることにより、これまで隠されていた子どもの脳の発達の「新たな臨界期」の存在を明らかにすることができました。将来的には、ヒトの子どもの脳の正常な発達やその異常による発達障害の理解に貢献することが期待されます。
本研究は、国立遺伝学研究所 神経回路構築研究室の 二橋彩音 総研大大学院生と 岩里琢治 教授が中心となり、同研究所の中川直樹 助教(現 京大 准教授)、佐藤拓也 技術支援員、Luwei Wang 研究員、鐘巻将人 教授、相賀裕美子 教授、安島理恵子 助教(現 基礎生物学研究所 准教授)、及び、生理学研究所の吉村由美子 教授、山本真理子 博士研究員との共同研究により行われました。
本研究は、日本学術振興会(JSPS)科研費(JP23KJ1001, JP21H05702, JP23H04242, JP24K02127, JP21H04719, JP23H04925, JP24H00586, JP21K18245, JP20H03346)、学術変革領域 (A)「動的脳機能創発」(JP24H02310)、生理研共同研究(24NIPS103)、JST-SPRING(JPMJSP2104)の支援を受けて行われました。
本研究成果は、国際科学雑誌 「iScience」 に2025年7月29日にpre-proofでオンライン掲載されました。
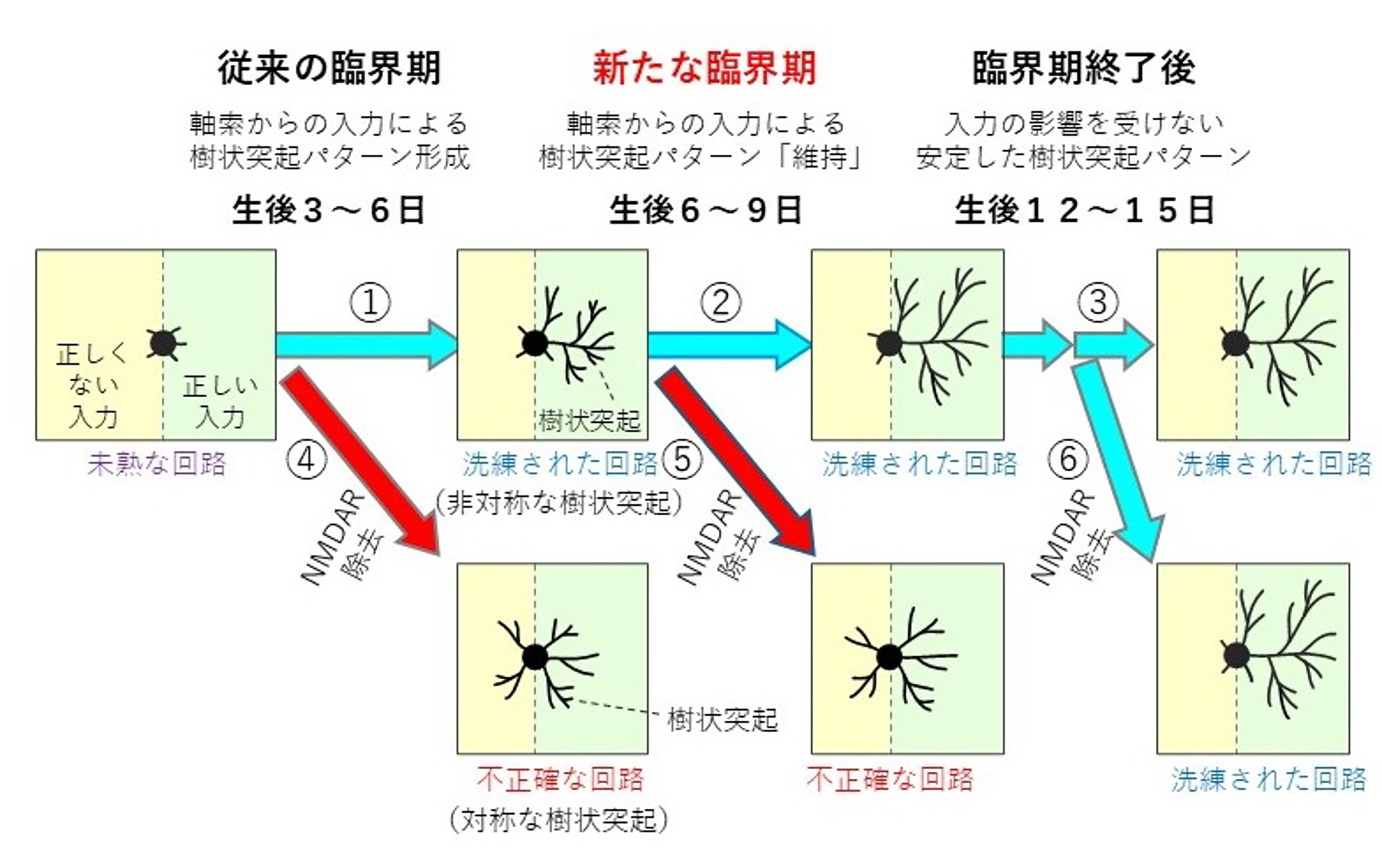
図: AID2法を用いた発達段階特異的なNMDAR除去が見出した、神経回路精緻化の「新たな臨界期」















