遺伝子内部におけるクロマチン修飾の役割と制御機構
Gene-body chromatin modification dynamics mediate epigenome differentiation in Arabidopsis
Soichi Inagaki, Mayumi Takahashi, Aoi Hosaka, Tasuku Ito, Atsushi Toyoda, Asao Fujiyama, Yoshiaki Tarutani, Tetsuji Kakutani
The EMBO Journal. Published online 18.01.2017 DOI:10.15252/embj.201694983
ヒストンH3の9番目のリジンのメチル化(H3K9me)やDNAのシトシン残基のメチル化は、トランスポゾンの転写抑制を介してゲノムの安定性に寄与しています。不思議なことに、これらの抑制目印は転写制御領域として知られるプロモーターだけではなく、遺伝子の内部(body)にも見つかります。今回我々は、活性な遺伝子の内部に抑制目印が蓄積するシロイヌナズナの変異体を用いて、遺伝子内部におけるクロマチン修飾の制御と意義にアプローチしました。シロイヌナズナの変異体ibm1では、多数の活性遺伝子の内部にH3K9meやDNAメチル化が蓄積し、結果的に花や葉などの発生異常が引き起こされます(図のA)。今回の研究では、ibm1変異体背景であるにも関わらず発生異常が生じない新たな変異体を同定し(図のA)、これを用いることで下流経路の理解を目指しました。同定された変異体の原因遺伝子であるLDL2はヒストン脱メチル化酵素をコードしていました。ヒストン修飾解析などから、LDL2が遺伝子内部の修飾による転写抑制を仲介することがわかりました。興味深いことにLDL2は、これまでに機能がはっきりしていなかったH3リジン4のモノメチル化(H3K4me1)を遺伝子内部において減少させることで転写抑制を引き起こしていました。同様に、遺伝子内部の修飾による転写抑制経路が多くのトランスポゾンでも働いていることがわかりました。本研究の結果は、これまで注目されてこなかった遺伝子内部に局在するH3K4me1の重要性を示すとともに、生物がトランスポゾンを特異的に抑制する機構の理解につながるものです。
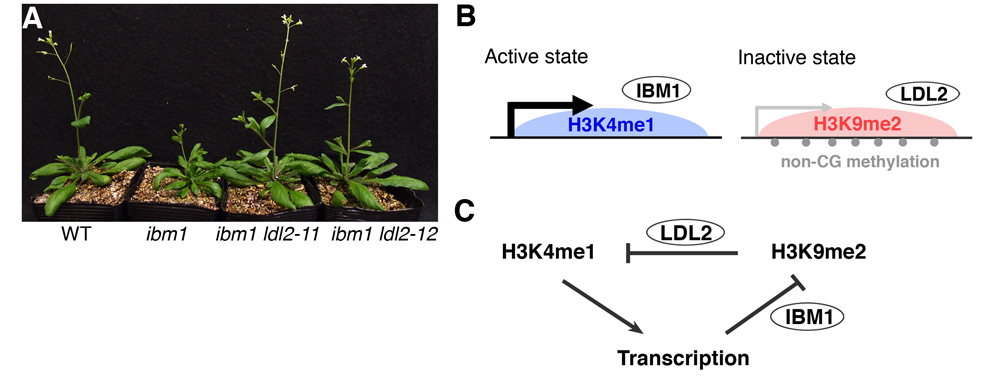
(A) ibm1変異体は小さく異常な形態の葉などの発生異常を示すが、ibm1 ldl2二重変異体は発生異常が回復する。(B)活性な状態と不活性な状態のクロマチンにおける修飾状態はIBM1、LDL2の2つのヒストン脱メチル化酵素によって制御される。(C)フィードバックモデル。転写している領域ではIBM1が働き、H3K9me2を抑える。逆に、H3K9me2が蓄積するとLDL2が働き、H3K4me1を減少させることで転写を抑える。















