Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
太田朋子名誉教授が文化勲章を受章
本研究所名誉教授である、太田朋子博士が2016年文化勲章を受章されました。 文化勲章受章者は、原則として前年度までの文化功労者の中から選ばれます。 太田博士は2002年に文化功労者として顕彰されました。 文化勲章親授式は11月3日に皇居で行われました。
<功績>
太田博士の主な業績は、集団遺伝学分野で「ほぼ中立説」という理論を確立したことです。1960年代には、より生存に有利なものが生き残るという自然選択(淘汰)説が広く受け入れられていましたが、当時遺伝研集団遺伝部長であった木村資生 遺伝研名誉教授は、生物集団内に広まる突然変異のほとんどは有利でも不利でもないとする「中立説」を提唱しました。太田博士は木村博士の共同研究者として中立説の確立に貢献しました。さらに太田博士は、中立説だけではつじつまの合わない現象を説明するために、生存に少しだけ不利な弱有害変異という考え方を導入した「ほぼ中立説」を確立しました。この理論は、現在の最先端研究にも大きな影響を与えています。

<参考資料>
クラフォード賞受賞の発表ページ(Royal Swedish Academy of Science)
数理モデルからクロマチンの構造を知る
![]()
Dynamic nucleosome movement provides structural information of topological chromatin domains in living human cells
Soya Shinkai, Tadasu Nozaki, Kazuhiro Maeshima, Yuichi Togashi
PLOS Computational Biology. 12(10), e1005136 DOI:10.1371/journal.pcbi.1005136, 2016
真核生物における長大なゲノムDNAは、ヌクレオソーム、さらにはクロマチンを形成することによって極小な細胞核に収納されています。国立遺伝研の野崎慎(元・特別共同利用研究員/慶応大)、前島一博教授らは、生きている細胞のヌクレオソームを1分子レベルで観測することで、クロマチンの動的な性質の理解に努めてきました(図左)。ヌクレオソームの動きはブラウン運動のように、主に熱ゆらぎによって支配されていますが、実際に観察された動きはブラウン運動から予想される動きよりもはるかに小さく、これまで理論的に説明するモデルがありませんでした。今回、広島大学の新海創也助教、富樫祐一准教授らは、このヌクレオソームの動きを説明するための数理モデルを考案し、その動態を表現する理論式を導出しました。この理論式には、クロマチンの構造を表すパラメータが含まれているため、ヌクレオソームの動きからクロマチンの構造を理解できることが、理論的に明らかになりました。(図右)。そして、これまで観察されていたヌクレオソームの動きの違いは、クロマチン構造による拘束の違いに起因することが分かりました。さらに、実際に理論式と実験データを比較することによって、生細胞のヌクレオソームの動きからクロマチンの構造情報を得ることにも成功しました。
本研究での数理モデルに基づく解析を展開することで、クロマチンの「構造」と「動態」の関係性、さらに両者が支配する遺伝子発現調節機構の解明につながることが期待されます。
本研究は広島大学大学院理学研究科・クロマチン動態数理研究拠点との共同研究です。新学術領域「少数性生物学」のサポートを受けました。
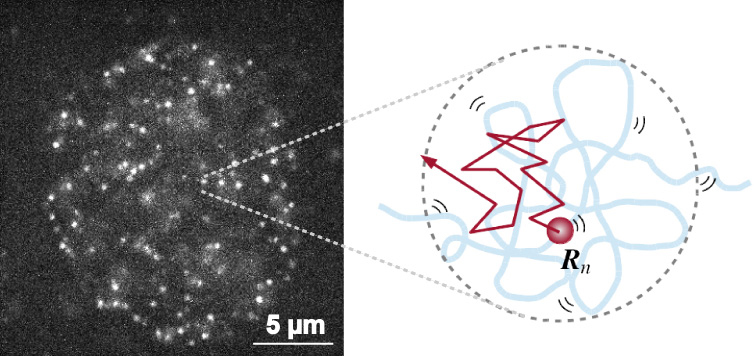
生きた細胞の核内のヌクレオソームを1分子レベルで観察した(左)。ヌクレオソームはクロマチン構造によって制限された中、ゆらいでいる(右)。ヌクレオソームの動きに対して、数理モデルを適用することで、クロマチン構造情報を得ることができる。
どの領域・細胞種の脳細胞でも高輝度標識し、任意の遺伝子を改変する新技術「Supernovaシリーズ」
![]()
Supernova: A Versatile Vector System for Single-Cell Labeling and Gene Function Studies in vivo
Wenshu Luo*, Hidenobu Mizuno*, Ryohei Iwata, Shingo Nakazawa, Kosuke Yasuda, Shigeyoshi Itohara, Takuji Iwasato(*equal contribution) Scientific Reports 24:35747. doi:10.1038/srep35747国立遺伝学研究所 形質遺伝研究部門(岩里研究室)の羅研究員(元総合研究大学院大学大学院生)と水野助教らは、脳の細胞中で遺伝子機能を解析するための、新規ベクターシステム「Supernovaシリーズ」を開発しました。このシステムは簡便かつ高性能で、幅広い用途に適用できます。
哺乳類の脳は、無数の神経細胞(ニューロン)が複雑なネットワーク(神経回路)を作ることで、様々な機能を生み出しています。脳の中に高密度で存在するニューロンから一部だけをランダムに選んで標識し、その細胞のみで目的の遺伝子をノックアウトすることができれば、脳の神経回路が形成され、機能するしくみを細胞レベル、分子レベルで理解することにつながります。しかしながら、これまでにまばらな細胞標識と遺伝子ノックアウトの両方を効率よくできるシステムはありませんでした。
本成果のSupernova法では2種類または3種類のベクターを組み合わせて細胞に導入するだけで、少数の細胞のみを蛍光タンパクで可視化できるとともに、可視化された細胞だけで目的の遺伝子をノックアウトすることが可能となります。遺伝子ノックアウトには、floxマウスとよばれる遺伝子組換マウスを用いる手法に加え、ゲノム編集の手法(TALENとCRISPR/Cas9)も利用できるようになり、Supernova法は広範なモデル生物に使うことができます。また、ベクター導入にウイルスを用いる手法も利用できるので、脳以外の組織にも用いることができます。本手法によって遺伝子改変による細胞の挙動などの変化を追跡することが可能です。
今回開発された手法は神経科学にとどまらない幅広い生命科学分野で、単一細胞における遺伝子機能解析に貢献することが期待されます。
本研究は、情報・システム研究機構 国立遺伝学研究所 形質遺伝研究部門(岩里研究室)にて、羅ブンジュウ研究員(元総合研究大学院大学大学院生)と水野秀信助教が中心となり、岩田亮平博士(同)、中沢信吾氏(総合研究大学院大学大学院生)の協力のもとおこなわれました。AAVを用いたシステムの構築では、理研脳センター 行動遺伝学技術開発チーム[安田光佑博士(元研究員)、糸原重美博士(シニアチームリーダー)]の協力を受けました。この研究は新学術領域研究(「スクラップ&ビルド」、「適応回路シフト」)など科研費の支援を受けて行われました。
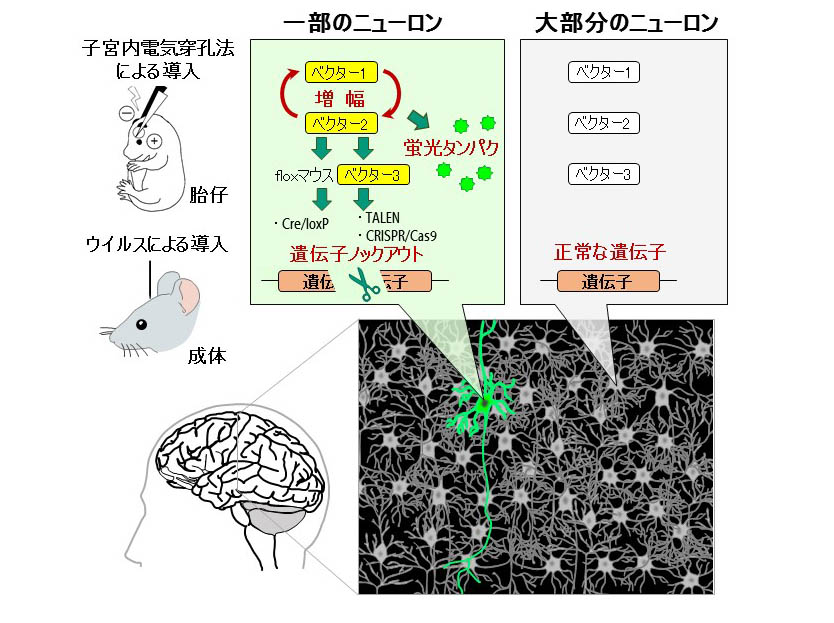
Supernova法のしくみ:2種類のSupernovaベクター(ベクター1、ベクター2)を組み合わせて脳に導入することで、ベクター1とベクター2を取り込んだ細胞のうちの一部でのみ正のフィードバックにより蛍光タンパクの発現の増幅が起こり、強い蛍光を発する。floxマウスと呼ばれる遺伝子組換マウスを用いるとCre/loxP法で目的の遺伝子をノックアウトできる。また、TALENやCRISPR/Cas9法を利用したベクター3を導入すれば、遺伝子組換動物を用いずに目的の遺伝子をノックアウトすることもできる。ベクターは、子宮内電気穿孔法あるいはアデノ随伴ウイルスを用いて導入する。
国立遺伝学研究所長の決定について
大学共同利用機関法人情報・システム研究機構では、平成28年11月30日をもって任期満了となる国立遺伝学研究所長について、同機構教育研究評議会での審議を経て、桂 勲 氏を次期国立遺伝学研究所長とすることを決定しましたので、お知らせします。
なお、研究所長は、平成28年12月1日付けで発令となります。
(任期:平成28年12月1日~平成30年11月30日(2年))
アフリカツメガエルの複雑なゲノムを解読:脊椎動物への進化の原動力「全ゲノム重複」の謎に迫る
![]()

Genome evolution in the allotetraploid frog Xenopus laevis
国際アフリカツメガエル・ゲノムプロジェクト・コンソーシアム
《 代表:平良 眞規(東京大学)、ダニエル・ロクサー & リチャード・ハーランド(カリフォルニア大) 》
Nature. 538, 336–343 (20 October 2016) DOI:10.1038/nature19840
さまざまな生物の全ゲノム解読は、全遺伝子の解明を通じて広く生命科学に寄与するとともに、生物進化の研究に多くの知見をもたらしてきました。多くの動物は父方と母方からの同一のゲノムをもつ「二倍体」ですが、アフリカツメガエルは、異種交配と全ゲノム重複により一つの生物の中に異なる2種類のゲノムをもった「異質四倍体」とされていました。そのため、非常に有用なモデル生物であるにもかかわらず、全ゲノム解読が非常に困難と諦められ、主要モデル生物の中で唯一行われていませんでした。しかし日本とアメリカを中心とする国際コンソーシアムは、アフリカツメガエルの全ゲノム解読に挑み、見事その全貌を明らかにしました。得られた情報は今後生物学から医学に至るさまざまな研究分野に大きく貢献すると期待できます。加えて、アフリカツメガエルのゲノムの中にある2種類のゲノム(サブゲノム)が別々の染色体のセットに分かれて存在するという重要な発見をしました。それにより、このカエルは約1800万年前に、2つの種が異種交配と全ゲノム重複を起こして誕生した異質四倍体であること、その後2つのサブゲノムが一つの生物の中で異なる進化を辿ったことが明確に示されました。今日の地球上には実に多様な種類の脊椎動物が生息し繁栄していますが、その最大の要因と考えられるのが約5億年前の古生代カンブリア紀に起きたとされる「2回の全ゲノム重複」です。その謎を解くための重要な鍵、いわゆるロゼッタストーンとしてアフリカツメガエルのサブゲノムの進化の仕組みが役立つことになります。これは生命科学における画期的な成果です。
国立遺伝学研究所 先端ゲノミクス推進センター・生命情報研究センター比較ゲノム解析研究室の藤山秋佐夫・豊田敦グループは本国際プロジェクトにおいて、当初から共同研究を推進し、BAC、fosmidライブラリの構築と両端および全長配列決定、ゲノムブラウザ構築および提供による国内における情報共有、FISH用BAC、fosmidクローンの調製、RNA-seq解析など多岐にわたる過程で本プロジェクトに貢献しました。また本プロジェクトは主に科研費新学術研究「ゲノム支援」(国立遺伝学研究所、東京大学、国立成育医療研究センター)、科研費・基盤(A、B、C)による支援のもとで進められました。

図1. アフリカツメガエルとネッタイツメガエル。(a)成体メスの比較。外見は良く似ているが、アフリカツメガエルの方がネッタイツメガエルより大きい。(b)頭部の拡大図。アフリカツメガエル(上)とネッタイツメガエル(下)では顔つきが異なる。このアフリカツメガエルは近交系のJ系統である。(c)胚の比較。アフリカツメガエル(上)とネッタイツメガエル(下)の胚。アフリカツメガエルとネッタイツメガエルの卵の直径はそれぞれ1.2 mmと0.7 mmであり、アフリカツメガエルの方が大きく、この時期の胚も大きい。
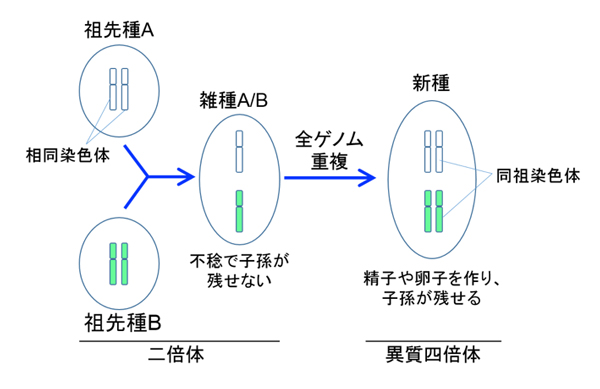
図2. 異質四倍体は雑種の全ゲノム重複によってつくられる。ここでは簡単にするため祖先種の染色体は1対のみを描いてある。実際の染色体数は、祖先種は9対もち、アフリカツメガエルは18対をもつ。
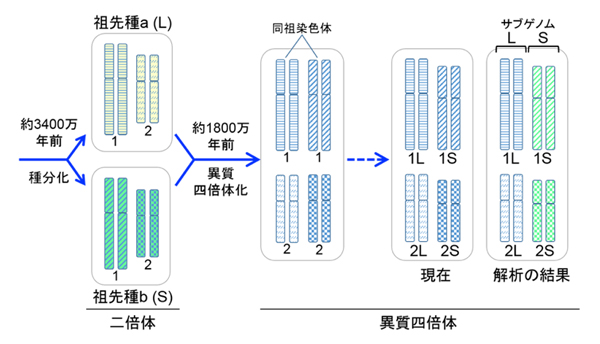
図3. 異質四倍体は祖先種に由来する2つのサブゲノムをもつ。ここでは簡単にするため祖先種aとbの染色体は1番と2番の2対のみを描いた(実際は祖先種は9対でアフリカツメガエルは18対である)。異質四倍体化の直後は、同祖染色体間に区別がないが現在までに一方が短くなったと考えられる。そこで長い方をL(long)、短い方をS(short)と命名した。今回、詳細なゲノム解析を行った結果、染色体LのセットとSのセットが、祖先種由来のゲノム(これをサブゲノムという)にそれぞれ対応することが示された。そこで、二つのサブゲノムをLとSと命名し、さらに祖先種もLとSと命名した。この発見により、倍数化後のサブゲノムの変化を解析することが可能となった。
◇本論文に関わった日本チームの機関と共著者一覧(18機関、23研究室)
東京大学(平良眞規、近藤真理子、道上達男、鈴木穣)、国立遺伝学研究所(藤山秋佐夫、豊田敦)、名古屋大学(松田洋一、宇野好宣)、広島大学(高橋秀治、彦坂暁、鈴木厚)、基礎生物学研究所(上野直人、山本隆正、高木知世)、産業技術総合研究所(浅島誠、原本悦和、伊藤弓弦)、北海道大学(福井彰雅)、長浜バイオ大学(荻野肇)、山形大学(越智陽城)、国立成育医療研究センター(黒木陽子)、東京工業大学(田中利明)、徳島大学(渡部稔)、立教大学(木下勉)、メリーランド大学(太田裕子)、北里大学(回渕修治、伊藤道彦)、バージニア大学(中山卓哉)、新潟大学(井筒ゆみ)、沖縄科学技術大学院大学(安岡有理)
◇主な研究費
科研費新学術研究「ゲノム支援」(国立遺伝学研究所、東京大学、国立成育医療研究センター)、科研費・基盤(A、B、C)
◇その他の主な機関と主な共著者
カリフォルニア大学バークリー校(米国)(アダム・セッション、ダニエル・ロクサー、リチャード・ハーランド)、ウルサン国立科学技術研究所(韓国)(テジュン・クワン)、ラドバウンド分子生命科学研究所(オランダ)(サイモン・ファン・ヘーリンゲン、ガート・ヴィーンストラ)、ソーク研究所(米国)(イアン・キグレイ)、沖縄科学技術大学院大学(日本)(ダニエル・ロクサー、オレグ・シマコフ)















