Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
染色体のセントロメア形成に関わる分子スイッチを発見
![]()
分子遺伝研究部門・深川研究室
Histone H4 Lys 20 mono-methylation of the CENP-A nucleosome is essential for kinetochore assembly
Tetsuya Hori, Wei-Hao Shang, Atsushi Toyoda, Sadahiko Misu, Norikazu Monma, Kazuho Ikeo, Oscar Molina, Giulia Vargiu, Asao Fujiyama, Hiroshi Kimura, William C. Earnshaw, and Tatsuo Fukagawa Developmental Cell Volume 29, Issue 6, p740–749, 23 June 2014 doi:10.1016/j.devcel.2014.05.001DNAを運ぶ染色体は、細胞分裂のたびに新たな細胞へと正確に分配されていきます。染色体分配に異常がおこると、細胞に様々な問題がおきます。がんを始めとする各種遺伝性疾患の多くは、染色体の分配不全が原因でおきています。したがって、染色体分配についての研究は、基礎生物学の知識探求としてだけでなく、医科学的にも重要な課題です。 この染色体分配に重要な働きを担うのがセントロメアです。セントロメアは染色体の中央部に存在し、染色体が引っ張られるための足場として働いています。正確な染色体分配がおこるためには、染色体のある一カ所にセントロメアが形成されなければなりません。しかしながら、セントロメアはどのように形成されるのかと言うメカニズムは不明であり、世界中の研究者が熱心に探究してきました。 これまでにわかっていたことは、長いひも状のDNAが巻き付くヒストンというタンパク質の特徴が、セントロメア形成に大きく関わっているということです。つまり、DNAは8個のヒストンに巻き付いていますが、そのうちの一部に「CENP-A」というヒストンが含まれていると、そこにセントロメアが形成されます。 しかし、単純にCENP-Aが存在するだけでは、セントロメアは形成できません。そこで、我々は、CENP-Aを活性化する分子スイッチが存在するのではないかと予想しました。 今回の実験で我々が明らかにしたのは、この分子スイッチです。我々は詳細な解析を行った結果、DNAが巻き付くヒストンとしてCENP-Aが取り込まれた後、残りのヒストンのうちのH4という種類のヒストンに特別な修飾が加わると、セントロメア形成が起こることを明らかにしました。この特別な修飾とは、ヒストンH4の20番目のリシン(Lys)残基がメチル化されることです。 セントロメア形成の分子スイッチを発見できたのは、高精度のゲノム解析や染色体工学を活用した技術開発によります。これらの実験により、この分子スイッチがセントロメア形成に必須であることを証明できました。 この分子スイッチを操作することによって、将来的にはがんをはじめとする染色体分配不全が原因でおこる各種遺伝性疾患の解明・治療も可能になると考えています。
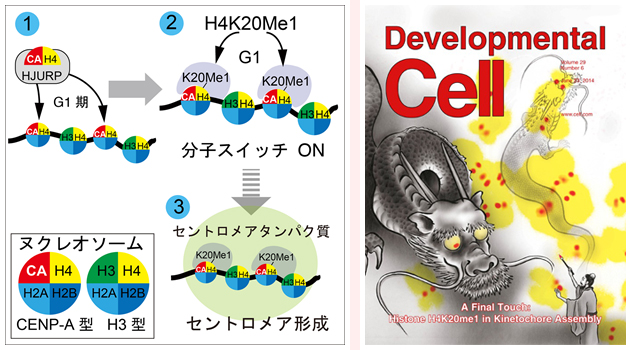
(左)セントロメア形成のモデル。
1.) CENP-AがHJURPという分子の介在でセントロメアへ取り込まれる。2) CENP-A近傍のH4の20番目のリシン残基がメチル化される (H4K20me1修飾: 分子スイッチON)。 3) 分子スイッチを引き金にセントロメア形成がおこる。
(右)今回の掲載誌の表紙。
画家がキャンバスにむけて竜の絵を書いている。目に最後の一筆をいれると竜がキャンバスからとびだす。このコンセプトは、H4K20me1による分子スイッチによりセントロメア形成が達成されるというコンセプトと類似している。
神経軸索の正常な伸長と経路選択を助ける膜タンパク質
Transcallosal Projections Require Glycoprotein M6-Dependent Neurite Growth and Guidance.
Sakura Mita, Patricia de Monasterio-Schrader, Ursula Fünfschilling, Takahiko Kawasaki, Hidenobu Mizuno, Takuji Iwasato, Klaus-Armin Nave, Hauke B. Werner, and Tatsumi Hirata. Cerebral Cortex DOI: 10.1093/cercor/bhu1294回膜貫通タンパク質M6aは軸索の先端に豊富に分布し、軸索伸長に関わる可能性が、古くから培養実験により示唆されてきました。しかし一見矛盾する報告もあり、実際の生理的機能については不明でした。今回我々は、M6a遺伝子とそのホモログであるM6b遺伝子を同時に破壊する事で、これらのタンパク質が実際に生理的に軸索伸長に働くことを明らかにしました。M6aとM6bを欠損したマウスでは、左右の大脳半球をつなぐ軸索束である脳梁が顕著に細くなり、多くの軸索が脳梁に到達する前に伸長を停止してしまいます。さらに一部の軸索は行き先を誤って、大脳皮質外に伸びていることもわかりました。以上の結果は、M6タンパク質が、生体脳において、正常な軸索伸長と経路選択を保障する重要な役割を担うことを示しています。
形質遺伝研究室が開発したSupernovaシステムを用いた共同研究による成果です。
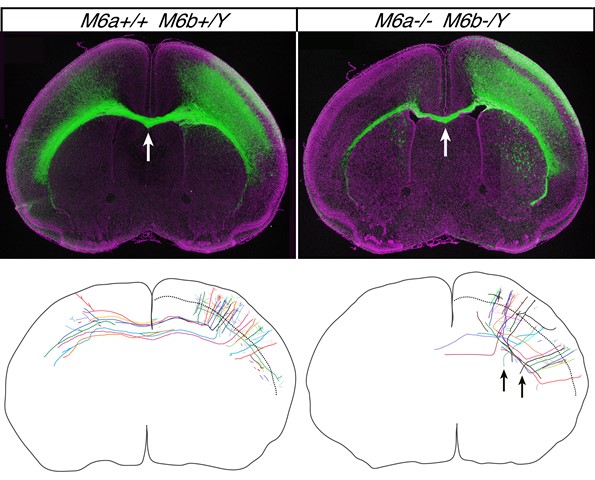
上:M6a/M6b 二重変異マウスの脳(右)では、左右大脳半球をつなぐ脳梁軸索(緑)の本数が著しく減少する(矢印)。下:Supernovaシステムによりトレースした軸索の形態。M6a/M6b 二重変異マウスの脳(右)では、軸索が短いだけでなく、走行方向が乱れ、間違った部位にも投射する(矢印)。
違った性質の攻撃行動には異なる遺伝子が関与する
Genetic mapping of escalated aggression in wild-derived mouse strain MSM/Ms: association with serotonin-related genes
Aki Takahashi, Toshihiko Shiroishi, Tsuyoshi Koide Frontiers in Neuroscience Front. Neurosci., 11 June 2014; doi:10.3389/fnins.2014.00156野生由来マウス系統であるMSMのオスは過剰な攻撃性を示します。マウス開発研究室の高橋阿貴助教らは、その過剰な攻撃行動の調節にかかわる遺伝子が少なくとも2つの染色体に存在し、それぞれの遺伝子は異なった性質の攻撃行動に関与していることを明らかにしました。また、この高い攻撃性にはセロトニン神経系に変化が生じていることを示しました。
マウスのオスは自らのなわばりを守るために、侵入者のオスに対して攻撃行動を示します。これは、相手を追い払うことが目的で、けがを負わせたり殺したりしてしまうことは、実験用マウスではほとんどありません。一方、日本の三島市で捕まえられた野生マウスを系統化したMSM系統のオスは、高い攻撃性を示し、離乳後にオス同士を一緒に飼育していると、性成熟後に激しいけんかが起こり、兄弟や、ときには交配相手であるメスを殺してしまうことがあります。このMSMの高い攻撃性に関わる遺伝子座を明らかにするために、哺乳動物遺伝研究室で作出されたコンソミックマウス系統群を用いて、順遺伝学的な手法を用いて解析を行いました。 コンソミックマウス系統とは、ほとんど全ての遺伝子は実験用マウスのC57BL/6J系統と同じなのですが、1種類の染色体(全部で21種類ある染色体のうちの1つ)のみMSM系統に由来するものを持っている系統です。コンソミック系統群の解析を行うことによって、私たちはMSMの高い攻撃性に関わる遺伝子が、4番染色体と15番染色体上に存在することを明らかにしました。また、それぞれの染色体が行動に及ぼす効果を調べることで、違った性質の攻撃行動にかかわっていることがわかりました。MSM型の4番染色体を持つコンソミック系統は攻撃をひとたび始めてしまうと、異常に高いかみつき行動や追いまわし行動を行い、交配相手のメスに傷を負わせるような個体も存在しました。一方、MSM型の15番染色体を持つコンソミック系統は、多くの個体が攻撃を開始しやすい傾向にあるのですが、攻撃を始めてもその頻度はそれほど高くないという特徴を持ちました。 攻撃行動には脳内のセロトニンが関与することが多くの研究から報告されています。今回、私たちはMSMとコンソミックマウス系統の脳内のセロトニン関連遺伝子の発現を調べ、MSMや高い攻撃行動を示すコンソミック系統において、セロトニンの合成酵素であるTph2遺伝子の発現が増加しており、セロトニン神経系に変化が生じていることも明らかにしました。 今回の研究は、攻撃行動の調節に関わる遺伝子がそれぞれ違った性質の攻撃性に関与しており、その遺伝的基盤の複雑さを示しています。今後、攻撃行動と遺伝子の関係をより深く理解する上で重要な情報をもたらしてくれると考えられます。
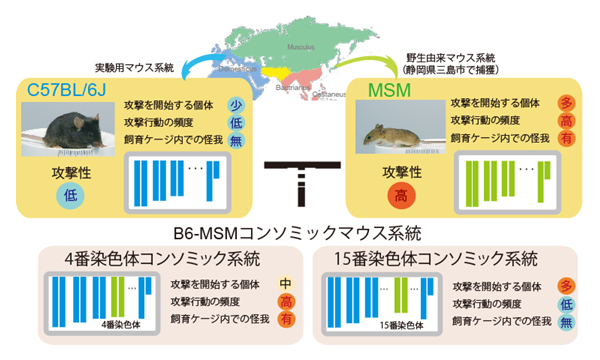
コンソミックマウス系統を用いたMSMの過剰な攻撃行動に関わる遺伝子座の探索















