2013/01/18
動原体の形成基盤となるCENP-T構造の解明
CENP-T provides a structural platform for outer kinetochore assembly
Tatsuya Nishino, Florencia Rago, Tetsuya Hori, Kentaro Tomii, Iain M. Cheeseman, and Tatsuo Fukagawa
The EMBO Journal, 2013 Feb 6;32(3):424-36. DOI: 10.1038/emboj.2012.348
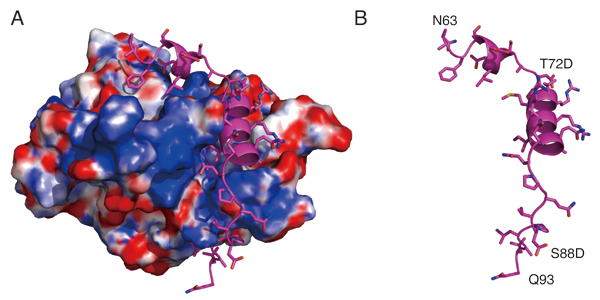
動原体(キネトコア)は、紡錘体微小管と結合する染色体上の重要構造体である。動原体タンパク質であるNdc80複合体は、微小管と直接結合することが知られている。しかしながら、このNdc80複合体が他の動原体タンパク質とどのように結合しているのかについては、不明な点も多い。本研究では、高解像度の構造解析によって、CENP-TのN末端側が、Ndc80複合体を構成するSpc24/25部分と直接に結合していることを明らかにした。特に、この結合はCENP-TのCDK(サイクリン依存的カイネース)によるリン酸化に依存しておこることも明らかになった。また、構造解析によって、リン酸化されたCENP-Tの72番目のT残基(T72)が直接にSpc24/25と結合するのではなく、リン酸化されたT72が近傍のリジン残基(R74)と水素結合をつくり、CENP-Tのαヘリックス構造とSpc24/25との安定な疎水結合を保証しているという分子基盤が明らかになった。さらに、生化学的な解析によって、CENP-TはNdc80複合体と結合するMis12複合体とは排他的に、Ndc80複合体と結合することも明らかになった。今回の研究により、動原体の分子構成の実体の理解が深まった。

(A)Spc24/25複合体に結合したCENP-T構造(シアン) (B)Aの図からCENP-Tのみ取り出した構造リボン図















