Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
中心体生物学研究部門の北川教授が日本生化学会奨励賞を受賞


第89回日本生化学会大会が、仙台国際センター/東北大学川内北キャンパス にて2016年9月25日(日)~27日(火)に開催されました。
中心体生物学研究部門の北川大樹教授が日本生化学会奨励賞を受賞しました。
受賞名:平成28年 日本生化学会奨励賞
受賞テーマ:中心小体複製の分子機構の研究
ヒト培養細胞の放射線耐性を向上させる新規タンパク質をクマムシのゲノムから発見
![]()
Extremotolerant tardigrade genome and improved radiotolerance of human cultured cells by tardigrade-unique protein
Takuma Hashimoto, Daiki D. Horikawa, Yuki Saito, Hirokazu Kuwahara, Hiroko Kozuka-Hata, Tadasu Shin-I, Yohei Minakuchi, Kazuko Ohishi, Ayuko Motoyama, Tomoyuki Aizu, Atsushi Enomoto, Koyuki Kondo, Sae Tanaka, Yuichiro Hara, Shigeyuki Koshikawa, Hiroshi Sagara, Toru Miura, Shin-ichi Yokobori, Kiyoshi Miyagawa, Yutaka Suzuki, Takeo Kubo, Masaaki Oyama, Yuji Kohara, Asao Fujiyama, Kazuharu Arakawa, Toshiaki Katayama, Atsushi Toyoda, Takekazu Kunieda
Nature Communications 7, Article number: 12808 (2016) DOI:10.1038/ncomms12808
プレスリリース資料(東京大学 大学院 理学系研究科・理学部)
クマムシは、さまざまな極限環境に耐性を示す1mm未満の小さな動物で、ヒトの半致死量の約1000倍(4000 Gy)の放射線照射にも耐えます。しかし、こうした極限的な耐性を支える分子メカニズムはほとんど分かっていませんでした。
東京大学大学院理学系研究科の橋本拓磨特任研究員と國枝武和助教らの研究グループは、慶應義塾大学先端生命科学研究所の堀川大樹特任講師ら、国立遺伝学研究所等と共同で、クマムシの中でも高い耐性を持つヨコヅナクマムシの高精度なゲノム配列を決定し、クマムシに固有な多数の遺伝子を発見しました。これらのうちDsup (Damage suppressor) と名付けた遺伝子をヒト培養細胞に導入すると、放射線などによるDNA傷害が抑制され、放射線耐性が向上することが明らかになりました。これは、極限環境耐性をもつ動物の遺伝子を用いることで、他の動物の細胞に放射線耐性を付与した初めての例であり、これまでまったく知られていなかった放射線耐性の新たな戦略を明らかにしました。本研究グループはDsup以外にも多数のクマムシ固有遺伝子を見出しており、これらはクマムシの持つたぐいまれな耐性能力の基盤解明に貢献するとともに、有用な遺伝子資源として将来的には他の動物にもさまざまな耐性能力を付与する新規技術の開拓につながることが期待されます。
本研究は、東京大学大学院理学研究科 橋本拓磨特任研究員 國枝武和助教、国立遺伝学研究所生命情報研究センター 豊田敦特任教授、ライフサイエンス統合データベースセンター 片山俊明特任助教、慶應義塾大学先端生命科学研究所 堀川大樹特任講師 荒川和晴特任准教授らの共同研究の成果です。科学研究費補助金(特定領域研究「ゲノム」4領域 比較ゲノム 16064101、20017010、新学術領域研究「ゲノム支援」221S0002、基盤研究(B) 25281016, 16H02951、新学術領域研究「宇宙に生きる」16H01632)の支援を受けて実施しました。
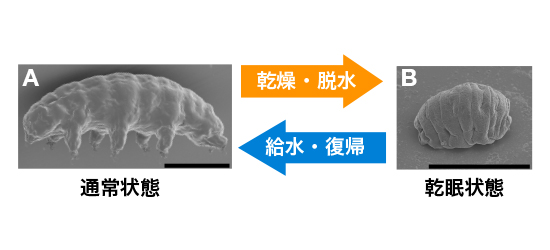
図1:本研究でゲノムを解読したヨコヅナクマムシ。
(A) 通常状態。ヒトの半致死量の約1000倍の放射線(4000Gy)の照射に耐える。
(B) 乾眠状態。外界の乾燥に伴い、ほぼ完全に脱水した乾眠状態に移行する。この状態では、放射線に加え、超低温、高温、真空、有機溶媒曝露などさまざまな極限環境に耐性を示す。給水により通常状態に復帰する。スケールバー、100μm
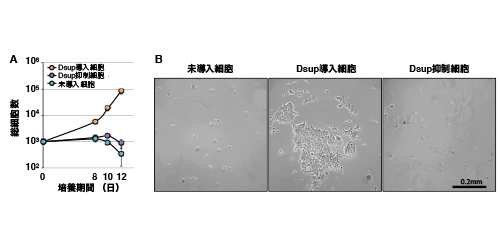
図2:(A)細胞に4GyのX線を照射し細胞数を計数した。Dsupを導入した細胞(オレンジ色)のみ顕著に増殖したのに対し、Dsupの発現を抑制した細胞(紫色)および未導入細胞(青色)では顕著な増殖はみられなくなった。
(B)培養開始後12日目のX線を照射した細胞の位相差顕微鏡像。
遺伝情報分析研究室の学生 飯塚朋代さんが第18回日本進化学会 優秀学生ポスター発表賞を受賞

日本進化学会 第18回年会が、東京工業大学 大岡山キャンパスにて2016年8月25~28日に開催されました。
遺伝情報分析研究室の学生 飯塚朋代さんが日本進化学会 優秀学生ポスター発表賞を受賞しました。
受賞名:第18回 日本進化学会 優秀学生ポスター発表賞
受賞テーマ:担子菌類における隔壁孔キャップの
平行進化の原因遺伝子予測
日本進化学会 学会賞受賞者(2016年)掲載ページ ページの中ほどを御覧ください
遺伝研 公開講演会2016 – 講演の動画を配信中
マウス生殖細胞の雌化因子を同定(卵巣内で精子分化開始)
![]()
Sexual Fate Change of XX Germ Cells Caused by the Deletion of SMAD4 and STRA8 Independent of Somatic Sex Reprogramming
Quan Wu, Kurumi Fukuda, Yuzuru Kato, Zhi Zhou, Chu-Xia Deng, Yumiko Saga
PLOS Biology September 8, 2016 DOI:10.1371/journal.pbio.1002553
ヒトを含め哺乳動物の性は性染色体の構成によって決まります。XX染色体を2本もつ個体は雌になり、卵巣の中には卵子ができます。一方、XY染色体をもつ個体は雄になり、精巣の中で精子が形成されます。精子や卵子の元となる始原生殖細胞は卵巣や精巣とは別の場所でつくられ、胎児期の間に移動して、精巣あるいは卵巣に入るかで、将来精子を作るか卵子を作るかの運命が決まります。すなわち、生殖細胞の性は周りの環境によって決まるのです.しかし、そのメカニズムはよくわかっていませんでした。我々は以前、生殖細胞の雄化にはNANOS2というRNA結合タンパク質が必須であることを示していますが、雌化の仕組みは不明でした。
今回の研究では2つの因子SMAD4とSTR8を卵巣の生殖細胞のみでノックアウトすると周りの環境はメスであるにも関わらず、生殖細胞は雄化してNANOS2などの雄性遺伝子を発現し、精子前駆細胞とよく似た性質を示すことがわかったのです。従って、これらの2つの因子は生殖細胞を雌化する因子であり、これらの因子がないと生殖細胞は雄化することがわかりました。
最近、培養系でES細胞や、iPS細胞から始原生殖細胞を誘導できることが報告されていますが、その後の性分化には体細胞環境が必須です。今回の研究成果は、体細胞なしに、生殖細胞の性分化を操作できる可能性を示唆しています。またこれまで、精子の形成にはY染色体の下流因子が必須であると考えられてきましたが、今回の結果は生殖細胞の雄化には、そのような雄特異的な体細胞因子は必要ではないことを示唆しています。この研究は、「新学術領域研究:生殖細胞のエピゲノムダイナミクスとその制御及」び「基盤研究A」の支援を受けています。また筆頭著者の呉泉は総研大遺伝学専攻出身者で現在は神戸CDBで研究を続けています。
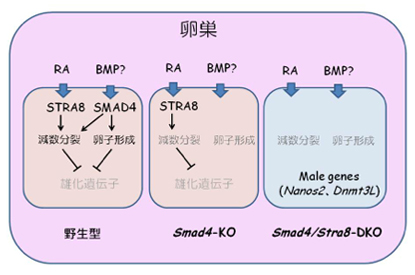
野生型の胎児卵巣の体細胞から分泌されるRAとBMPシグナル(仮説)がそれぞれ生殖細胞のなかでSTRA8とSMAD4を介して、雌化を誘導する。SMAD4単独のノックアウトでは性転換は起こらない。しかしこの2つの遺伝子がKOされると、減数分裂、卵子形成は完全にブロックされて、雄化がおこる。
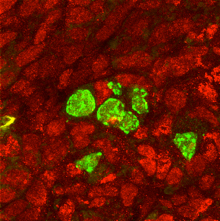
Smad4/Stra8ダブルノックアウト生殖細胞が卵巣の中で雄性因子PLZF(緑)を発現。赤は、卵巣体細胞特異的FOXL2の発現。
がんは腫瘍ホットスポットに生じる〜運命を左右する組織構造〜
![]()
Epithelial tumors originate in tumor hotspots, a tissue-intrinsic microenvironment.
Yoichiro Tamori, Emiko Suzuki, Wu-Min Deng
PLOS Biology Published: September 1, 2016 DOI:10.1371/journal.pbio.1002537
国立遺伝学研究所の田守洋一郎助教とフロリダ州立大学のウーミン デン教授の研究グループは、がん細胞が上皮組織内の特定の場所(腫瘍ホットスポット)で腫瘍形成を始める仕組みを明らかにしました。
過去数十年間にわたるがん研究の積み重ねから、がん遺伝子や、がん抑制遺伝子の変異ががんの原因になること、そして、変異細胞(前がん細胞)が正常な上皮組織に出現して異常に増殖すると腫瘍が生じることなどが明らかにされてきました。しかし、この異常な増殖が始まるがん最初期段階の仕組みはよくわかっていませんでした。
本研究では、モデル生物であるショウジョウバエの上皮組織において、前がん細胞が腫瘍形成を起こす場所(腫瘍ホットスポット)と起こさない場所(腫瘍コールドスポット)があることを発見しました。組織の大部分を占めるコールドスポットでは、前がん細胞は上皮組織から排除されて死んでいくのに対し、ホットスポットに出現した前がん細胞は上皮組織からはみ出て異常な増殖を開始します。また、ホットスポットでは組織構造がもともと少し異なっており、この違いが前がん細胞の運命を左右していることがわかりました。組織構造の少しの違いが前がん細胞の運命を左右するという考えは今までになかったものです。この新しい発見によって、がん発症の仕組みの理解がさらに進むものと期待されます。
本研究は国立遺伝学研究所 構造遺伝学研究センター 遺伝子回路研究室の田守洋一郎助教が中心となり、フロリダ州立大学のウーミン デン教授との共同研究として行われました。本研究の遂行にあたり、国内では、文部科学省科研費 研究活動スタート支援(26891025)、萌芽研究(15K14386)、新学術領域研究「細胞競合」(15H01500)、上原記念生命科学財団による支援を受けました。
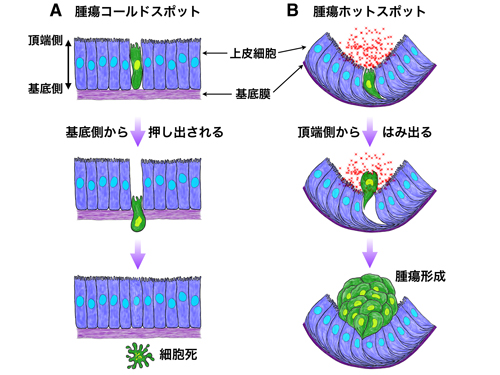
腫瘍ホットスポットで腫瘍が形成される仕組み。
(A)上皮組織の腫瘍コールドスポットに現れた前がん細胞(緑色)は、基底側から押し出されて細胞死を起こして組織から排除される。
(B)腫瘍ホットスポットに現れた前がん細胞は、頂端側からはみ出る。ホットスポットの頂端側には発がんに関与するシグナル(JAK/STAT経路)の活性化因子(Upd:赤)がもともと多く分泌されており、前がん細胞はUpdを取り込むことによって異常な増殖を始める。紫:基底膜。
縄文人の核ゲノム配列をはじめて決定〜東ユーラシア人の中で最初に分岐したのは縄文人だった〜
![]()
A partial nuclear genome of the Jomons who lived 3,000 years ago in Fukushima, Japan
Hideaki Kanzawa-Kiriyama, Kirill Kryukov, Timothy A. Jinam, Kazuyoshi Hosomichi, Aiko Saso, Gen Suwa, Shintaroh Ueda, Minoru Yoneda, Atsushi Tajima, Ken-ichi Shinoda, Ituro Inoue, Naruya Saitou
Journal of Human Genetics 1 September 2016; DOI:10.1038/jhg.2016.110
国立遺伝学研究所集団遺伝研究部門および総合研究大学院大学遺伝学専攻の斎藤成也教授らのグループは、福島県北部にある三貫地貝塚から出土した縄文時代人(縄文人)の歯髄からDNAを抽出して、核ゲノムの一部を解読することに成功しました。
これまで縄文人のDNAについては、ミトコンドリアDNAの情報しか得られていませんでした。今回、ミトコンドリアDNAの数千倍にあたる核ゲノムのDNA配列1億1,500万塩基対を決定しました。このゲノム情報を、現代日本列島人と比較解析したところ、縄文人はアイヌ人にもっとも近く、ついでオキナワ人、そしてヤマト人(アイヌ人とオキナワ人を除く日本列島人)に近縁であることが明らかになりました。さらに、縄文人は、現代人の祖先がアフリカから東ユーラシア(東アジアと東南アジア)に移り住んだ頃、もっとも早く分岐した古い系統であること、そして、現代の本土日本人に伝えられた縄文人ゲノムの割合は15%程度であることが明らかになりました。
今回、縄文人の核ゲノムの一部が解読されたことによって、縄文人が現代の東アジア人と比べて遺伝的に特異な集団であったことが明らかとなりました。今後、縄文人ゲノムデータを充実させ、それらを比較解析することによって、縄文人のたどった進化史が明らかになり、日本列島人の起源と成立を知ることにつながると期待されます。
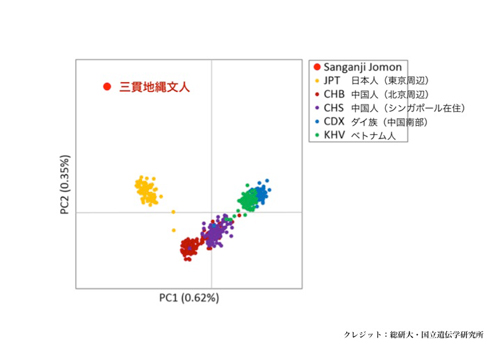
図1:三貫地縄文人(赤点)と他の人類集団ゲノムデータとの遺伝的近縁関係を主成分分析(PCA)
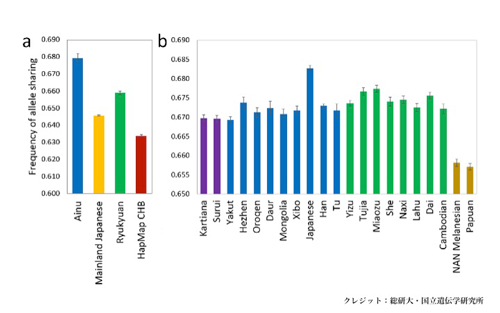
図2:三貫地縄文人と他の人類集団SNPデータとの対立遺伝子共有度
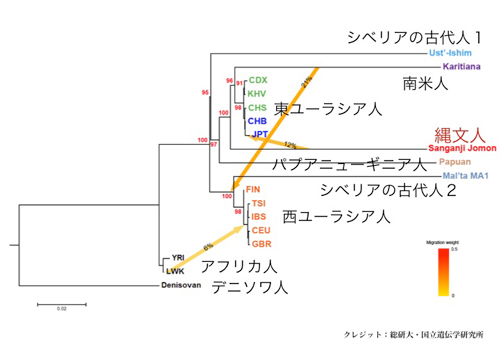
図3:三貫地縄文人と他の人類集団との系統樹
赤色数字は系統樹の枝の信頼性をしめすブーツストラップ確率を、矢印は混血をあらわす















