Archive
- Home
- 2026/2
- 2026/1
- 2025/12
- 2025/11
- 2025/10
- 2025/9
- 2025/8
- 2025/7
- 2025/6
- 2025/5
- 2025/4
- 2025/3
- 2025/2
- 2025/1
- 2024/12
- 2024/11
- 2024/10
- 2024/9
- 2024/8
- 2024/7
- 2024/6
- 2024/5
- 2024/4
- 2024/3
- 2024/2
- 2024/1
- 2023/12
- 2023/11
- 2023/10
- 2023/9
- 2023/8
- 2023/7
- 2023/6
- 2023/5
- 2023/4
- 2023/3
- 2023/2
- 2023/1
- 2022/12
- 2022/11
- 2022/10
- 2022/9
- 2022/8
- 2022/7
- 2022/6
- 2022/5
- 2022/4
- 2022/3
- 2022/2
- 2022/1
- 2021/12
- 2021/11
- 2021/10
- 2021/9
- 2021/8
- 2021/7
- 2021/6
- 2021/5
- 2021/4
- 2021/3
- 2021/2
- 2021/1
- 2020/12
- 2020/11
- 2020/10
- 2020/9
- 2020/8
- 2020/7
- 2020/6
- 2020/5
- 2020/4
- 2020/3
- 2020/2
- 2020/1
- 2019/12
- 2019/11
- 2019/10
- 2019/9
- 2019/8
- 2019/7
- 2019/6
- 2019/5
- 2019/4
- 2019/3
- 2019/2
- 2019/1
- 2018/12
- 2018/11
- 2018/10
- 2018/9
- 2018/8
- 2018/7
- 2018/6
- 2018/5
- 2018/4
- 2018/3
- 2018/2
- 2018/1
- 2017/12
- 2017/11
- 2017/10
- 2017/9
- 2017/8
- 2017/7
- 2017/6
- 2017/5
- 2017/4
- 2017/3
- 2017/2
- 2017/1
- 2016/12
- 2016/11
- 2016/10
- 2016/9
- 2016/8
- 2016/7
- 2016/6
- 2016/5
- 2016/4
- 2016/3
- 2016/2
- 2016/1
- 2015/12
- 2015/11
- 2015/10
- 2015/9
- 2015/8
- 2015/7
- 2015/6
- 2015/5
- 2015/4
- 2015/3
- 2015/2
- 2015/1
- 2014/12
- 2014/11
- 2014/10
- 2014/9
- 2014/8
- 2014/7
- 2014/6
- 2014/5
- 2014/4
- 2014/3
- 2014/1
- 2013/12
- 2013/11
- 2013/10
- 2013/9
- 2013/8
- 2013/7
- 2013/6
- 2013/5
- 2013/4
- 2013/3
- 2013/2
- 2013/1
- 2012/12
- 2012/11
- 2012/10
- 2012/9
- 2012/8
- 2012/7
- 2012/6
- 2012/5
- 2012/4
- 2012/3
- 2012/2
- 2012/1
- 2011/12
- 2011/11
- 2011/10
- 2011/9
- 2011/8
- 2011/7
- 2011/6
- 2011/5
- 2011/4
- 2011/3
- 2011/2
- 2011/1
- 2010/12
- 2010/11
- 2010/10
- 2010/9
- 2010/8
- 2010/7
- 2010/6
- 2010/5
- 2010/4
- 2010/3
- 2010/2
- 2009/12
- 2009/11
- 2009/10
- 2009/9
- 2009/8
- 2009/7
- 2009/6
- 2009/5
- 2009/4
- 2009/3
- 2009/2
- 2009/1
- 2008/12
- 2008/11
- 2008/10
- 2008/9
- 2008/7
- 2008/6
- 2008/5
- 2008/4
- 2008/3
- 2008/2
- 2008/1
- 2007/12
- 2007/11
- 2007/10
- 2007/9
- 2007/8
- 2007/7
- 2007/6
- 2007/3
- 2007/2
- 2007/1
- 2006/12
- 2006/11
- 2006/10
- 2006/9
- 2006/7
- 2006/6
- 2006/5
- 2006/4
- 2006/1
- 2005/6
- 2005/5
- 2005/4
- 2005/2
- 2004/12
- 2004/11
- 2004/10
- 2004/8
- 2004/7
- 2004/6
- 2004/5
- 2004/2
- 2004/1
- 2003/12
- 2003/8
- 2003/7
- 2003/6
- 2003/5
- 2003/3
- 2003/1
- 2002/12
- 2002/10
- 2002/5
- 2002/4
- 2002/2
- 2002/1
- 2001/8
- 2001/5
- 2001/4
- 2001/2
- 2000/8
- 2000/7
線虫胚の紡錘体における幅、長さと染色体量の定量的な関係性
Yuki Hara, Akatsuki Kimura
Mol. Biol. Cell 24 (9), 1411-1419, 2013 doi:10.1091/mbc.E12-07-0528
遺伝情報を担う染色体を分配する装置である「紡錘体」は、「ひし形」を回転させたような美しい形をしています。大きい紡錘体でも小さい紡錘体でも似たような「ひし形」ができあがるので、ひし形の縦と横のサイズの比は細胞内で何らかの制御を受けていると予想されますが、そのような制御についてはわかっていませんでした。細胞建築研究室の原裕貴(総研大遺伝学専攻、現在はドイツEMBL研究員)と木村暁は線虫胚発生時に生じる様々なサイズの紡錘体を定量化しました。その結果、紡錘体の縦と横の長さが単純な比例関係(isometry)にはなく、「ひし形の横幅が、斜辺の約0.6乗に比例する」という、少し複雑だがきれいな関係性(allometry)があることを見いだしました。染色体の量を変えると、ひし形の横幅が染色体量の約0.4乗に比例することも見いだしました。これらの関係性から、原研究員らは紡錘体のひし形構造を制御する新たな力学的機構について提唱しました。
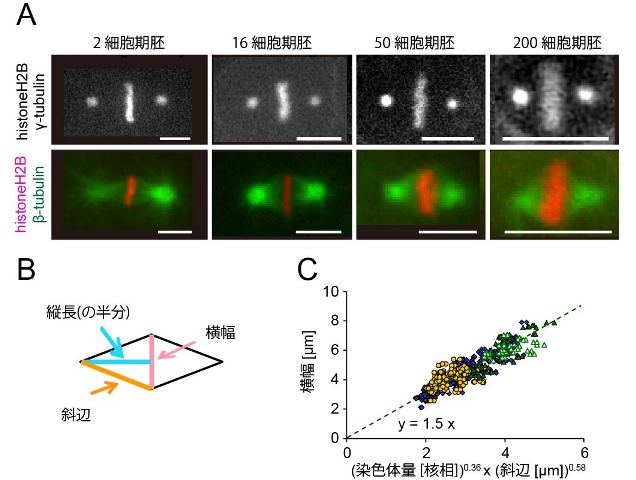
(A) 線虫胚における紡錘体の例(スケールバー=5 μm)。(B) 紡錘体の横幅(ピンク)、縦長の半分(青)と斜辺(オレンジ)の説明。(C) 通常(2倍体)の線虫(青)、1倍体の線虫(黄色)および多倍体の線虫(緑)について、紡錘体の横幅を染色体量(核相)の0.36乗と斜辺の0.58乗の積に対してプロットしたもの。(論文図を改変)
65回日本細胞生物学会大会で北川研究室・白土玄さん、前島研究室・野崎慎さんが同時受賞
 |
 |
|
| 受賞時の野崎さん | 受賞時の白土さん |
 第65回日本細胞生物学会大会
第65回日本細胞生物学会大会 新分野創造センター・北川研究室
新分野創造センター・北川研究室 構造遺伝学研究センター・前島研究室
構造遺伝学研究センター・前島研究室集団遺伝研究部門の隅山健太助教が第17回 日本細胞生物学会論文賞を受賞

- 論文名: Live Imaging of Protein Kinase Activities in Transgenic Mice Expressing FRET Biosensors
- Cell Structure and Function 37: 65-73(2012)
- 著者: Yuji Kamioka1, Kenta Sumiyama2, Rei Mizuno1, Yoshiharu Sakai1, Eishu Hirata1, Etsuko Kiyokawa1, Michiyuki Matsuda1
- 1京都大学, 2国立遺伝研
DNA複製:真核生物間で保存された、効率よい複製開始のためのタンパク間相互作用
Seiji Tanaka, Yayoi Komeda, Toshiko Umemori, Yumiko Kubota, Haruhiko Takisawa, and Hiroyuki Araki
Mol. Cell. Biol.(2013), 33 2614-2622. doi:10.1128/MCB.00431-13
真核生物の染色体DNA複製は、特定の領域(=複製起点)から開始します。染色体DNAは一度の細胞分裂周期の間に、一度だけ過不足なく正確に倍加されなくてはならないため、複製起点の活性化は細胞周期の間で厳密に制御されています。これまでの解析から、複製起点の活性化は大きく2段階の反応で起きることがわかってきました。すなわち、1) 細胞周期のG1期に、複製時ヘリカーゼ(DNA2本鎖巻き戻し酵素)が不活性型として複製起点にロードされ、2) S期ではヘリカーゼが活性型に変換し、DNA複製が開始します。活性型ヘリカーゼの形成は、タンパクキナーゼによるタンパクリン酸化をきっかけとした、複製起点上での新たなタンパク群の集合・リモデリングを含む複雑な反応です。私たちは、真核細胞のモデル細胞である出芽酵母を用いた研究から、Dpb11と呼ばれるタンパクがリン酸化された2種類のタンパクと特異的に結合することが、この反応の鍵となっていることを示してきました。
今回の研究では、このDpb11が、上記結合とは別の領域で活性型ヘリカーゼにのみ含まれるGINSというタンパク複合体と直接結合すること、この結合が効率よい複製起点の活性化に必要であることを見出しました。また、脊椎動物のDpb11ホモログであるTopBP1においても、酵母のDpb11同様、GINSと結合し複製開始に重要な働きをしている領域、すなわち機能的に同じ働きを持つ領域を見出しました。このことは、今回見出した Dpb11/TopBP1-GINS相互作用が真核生物のDNA複製開始において共通の重要な役割を果たしていることを示すものであり、今後、真核生物の染色体DNA複製開始の詳細なメカニズムの理解に役立つものです。
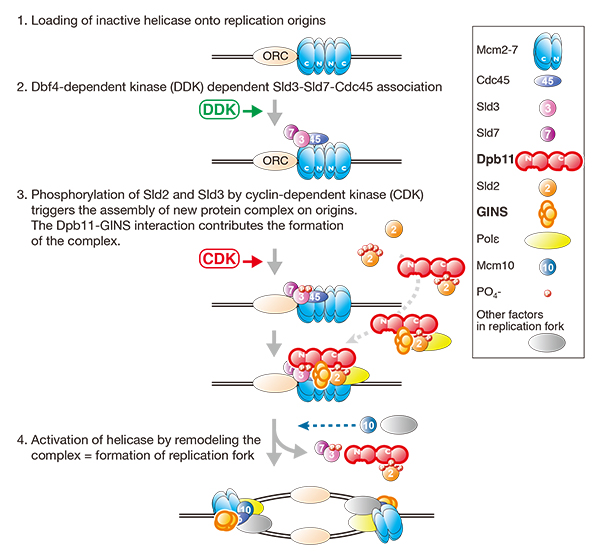
出芽酵母(S. cerevisiae)DNA 複製開始機構のモデル。Dpb11-GINSの相互作用が、複製開始に必要となる新たなタンパク複合体の形成に寄与している。















