- ゲノムインプリンティングとは?
ヒトをはじめとする哺乳類はすべて父親と母親に由来する一対のゲノムを持っている。従って、常染色体上のすべての遺伝子座に一対の対立遺伝子があり、通常それらはともに発現して個体の発生や生体の営みを調節している。
哺乳類では単為発生が致死であること、特定の染色体が片親に由来するダイソミーに異常がみられることからわかるように、正常発生には父親、母親由来の両方のゲノムが必須である。実際、哺乳類の常染色体には一方の対立遺伝子だけが発現する遺伝子座があり、これが父親、母親由来ゲノム間の機能的な差をもたらしている。つまり精子や卵子の形成過程において何らかの形で遺伝子に「しるし」あるいは「記憶」が刷り込まれ、そのしるしにしたがって子での遺伝子発現が生じる。これがゲノムインプリンティングまたはゲノム刷り込み(genomic imprinting)である。
インプリンティングは遺伝情報に恒久的変化を与えず、世代ごとに新たにプログラムされるので、遺伝とは異なるエピジェネティック(epigenetic)な現象である。佐々木裕之:「現代医学の基礎第5巻,生殖と発生」(岩波書店)第9章より引用
[用語説明]
単為発生(parthenogenesis):
単為生殖、処女生殖ともいう。卵が受精することなく単独に発生すること。ある種の動物では、単為発生することが知られており、ミツバチ・アブラムシ(アリマキ)・ミジンコなどの無脊椎動物でよく知られているが、鳥や爬虫類を含む多くの脊椎動物で単為発生がみられる(次節参照)。昆虫では例えば、ミツバチでは、卵が受精して発生するとメス(働きバチや女王バチ)になり、未受精で染色体が半数のまま発生するとオスになる。
ダイソミー(uniparental disomy):
マウスでは、核型は正常だが特定の染色体またはその一部が一対とも片親に由来する個体を作ることができる。これをダイソミーという。染色体領域が両方とも父親由来の時は父性ダソミー(paternal disomy)、母親由来の時は母性ダイソミー(maternal disomy)と呼ぶ。
- 父親母親由来ゲノムの役割分担
哺乳類の単為発生は致死である -父親・母親由来ゲノムの役割分担-
卵が受精することなしに単独に発生することを単為発生(parthenogenesis)とよぶ。自然界では鳥や爬虫類を含む多くの脊椎動物で単為発生がみられ、形態的にも機能的にも正常な個体を作りうるが、哺乳類においてはその例がない。たとえばマウスの未受精卵を人為的に刺激し、細胞分裂阻害剤で第二極体の分離を阻害して二倍体の単為発生胚をつくることができるが、これはすべて妊娠中期までに死亡してしまう(図1)。これはマウスの正常発生に精子(父親)由来ゲノムが必須であることを示唆している。
マウスの父親・母親由来ゲノムが機能的に不等価であることは、受精卵の核移植(nuclear transfer)の実験でさらに詳しく明らかにされた。すなわち受精卵では精子、卵子由来の核がそれぞれ雄性前核、雌性前核として観察されるが、微細なガラス針を使って一方の前 核を除去し、別の受精卵から採取した前核を移植することができる(図1)。このような再構成実験の結果、二倍体の雄核発生(andorogenesis)や雌核発生(gynogenesis)の胚もやはり子宮内致死であった。これから、両親由来ゲノムには何らかの違いが刷り込まれていると考えられる。
これらの胚の形態を観察すると、母親由来ゲノムだけを持つ単為発生胚と雌核発生胚は、胚体の発達は比較的よい(ただしサイズは小さい)が胎盤の栄養膜の発達が非常に悪い(図1)。逆に父親由来ゲノムだけを持つ雄核発生では、栄養膜はよく発達するのに対し胚体は貧弱なものしか観察されない(図1)。よって父親・母親由来ゲノムには対極的な働きがあり、父親由来ゲノムは栄養膜の発達に、母親由来ゲノムは胚体の発達に必須である。
ヒトの雄核発生は異常妊娠産物である胞状奇胎(hydatidiform mole)を生じるが、これは栄養膜が異常増殖した絨毛の変性塊であり、マウスの表現型と矛盾しない。また卵巣で未受精卵が単為発生すると奇形腫(teratoma)を生じ、さまざまな分化した組織像を呈する。よって哺乳類では両親由来ゲノムの役割が種をこえて保存されている。
単為発生胚や雄核発生胚に由来する細胞を正常胚細胞と混合しキメラ(chimera)胚を作成すると、正常細胞がこれらの細胞の欠陥をある程度補償するので、さらに詳しく分化能がわかる。その結果(1)単為発生細胞を含むキメラは正常胚より30~50%程度小さく、雄核発生細胞を含むキメラは同程度大きい、(2)単為発生細胞は生殖細胞、脳、心、腎、脾などで高い寄与率を示すが、骨格筋、肝、膵には分化できない、(3)雄核発生細胞は骨格筋、心、骨などに寄与するが脳での寄与率は低い、などがわかった。このように父親・母親由来のゲノムは胚の成長や各細胞系列の分化・増殖を調節している。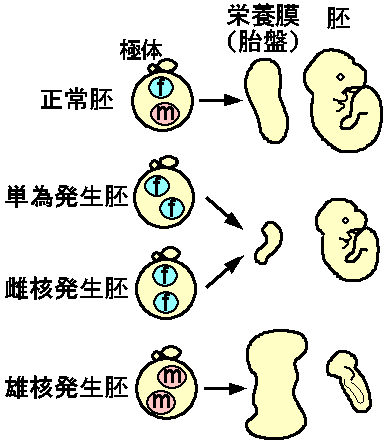
図1佐々木裕之:「現代医学の基礎第5巻、生殖と発生」(岩波書店)第9章より引用
- インプリンティングを受ける遺伝子
1991年、インプリンティングを受ける遺伝子の最初の例がノックアウト実験により偶然発見された。この遺伝子はマウスのインスリン様成長因子II(Igfz)で、その欠損についてホモ接合体の個体は子宮内の成長が阻害され、出生時体重が正常の60%ほどしかない。ところがヘテロ接合体を調べると、変異を母親から伝達された場合は正常で、父親から伝達された場合は欠損型であった。Igfzは父親由来の時だけ発現するインプリンティング遺伝子であり、これからこの伝達形式が説明できる(図2)。またこの遺伝子は第7染色体遠位部にある。この発見以来、ヒトとマウスで次々とインプリンティング遺伝子が同定され、現在(1998年)ではこのような遺伝子の数は30あまりに及ぶ。
インプリンティングを受ける遺伝子のどちらの対立遺伝子が発現するかは遺伝子ごとに決まっている。しかし常に対立遺伝子特異的な発現を示すわけではなく、組織や発生段階に依存したインプリンティングも観察される。たとえば上述のIgfzは、脳軟膜や脈絡叢では両方の対立遺伝子が発現する。また同一組織内で細胞ごとにインプリンティング状態が異なるモザイク状の(mosaic)インプリンティングや、個体ごとに異なる多型的(polymorphic)インプリンティングも報告されている。
インプリンティング遺伝子には次のような共通点がある。(1)ゲノム上でクラスターを形成する傾向がある。(2)遺伝子産物の機能は成長因子、ホルモン、膜表面受容体、転写因子、酵素など様々だが、細胞の増殖や成長を促進するものについては父性対立遺伝子、逆に増殖を阻害する遺伝子は母性対立遺伝子が発現する傾向にある。(3)いくつかの例外を除いてヒト・マウス間でインプリンティングが保存されている。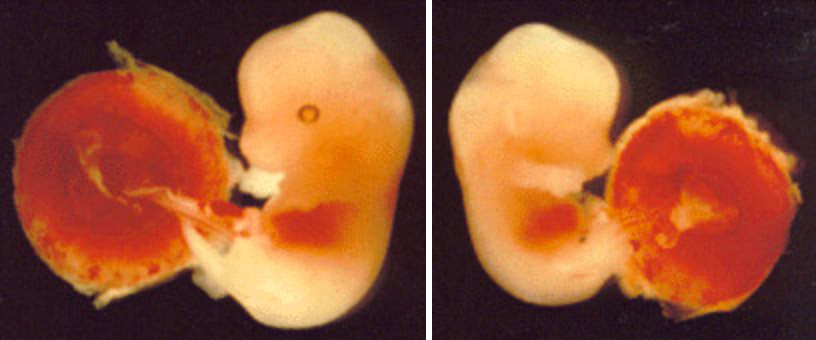
図2:マウス第7染色体遠位部の母性ダイソミー(右)と正常な胎仔(左)。この領域にはインプリンティングにより父性対立遺伝子だけが発現するインスリン様成長因子II遺伝子があり、この遺伝子の発現がない母性ダイソミーは対照より小さい。正常な胎仔はこのまま成長するが母性ダイソミーは子宮内致死である。(ダイソミーの目に色素がないのはマーカー遺伝子によるもので、ダイソミーによる異常ではない。)
佐々木裕之:「現代医学の基礎第5巻、生殖と発生」(岩波書店)第9章より引用
- インプリンティングの機構
図3には各世代の発生過程で起こるインプリンティングのサイクルを模式的にしめした。インプリンティングを受ける染色体領域または遺伝子は、配偶子形成(gametogenesis)過程で精子(父親)由来か卵子(母親)由来かの「しるし=インプリント(imprint)」を刷り込まれる。このインプリントの違いは受精を経て、同一の核に入っても維持され、さらに複製・細胞分裂を繰り返しても消失しない。そして体細胞ではインプリントにしたがって父性または母性対立遺伝子特異的な発現が起こる。一方生殖系列では始原生殖細胞で一旦インプリントの消去が起こり、つづいて配偶子形成過程で新たなインプリントの獲得が起こる。
インプリンティングのサイクルは、DNA配列に変化を与えないエピジェネティックな機構で回転する。そのような機構の代表はDNAメチル化(DNAmethylation)である。シトシンのメチル化は哺乳類ゲノムDNAの唯一の生理的な修飾であり、DNA(シトシン‐5)‐メチルトランスフェラーゼが2塩基配列CpGのシトシンを認識して5‐メチルシトシンを生成する(図4)。CpGに相補的な配列はやはりCpGであるから、2本鎖DNAは両鎖にメチル化の標的をもつ。
哺乳類は3種類のDNA(シトシン‐5)‐メチルトランスフェラーゼを持つ。そのうちDnmt1と呼ばれるメチルトランスフェラーゼは主に体細胞で発現し、一方の鎖がメチル化されたヘミメチル化(hemimethylated)CpGを優先的に認識し、相補鎖上のシトシンをメチル化する(維持メチル化、maintenance methylation)。この酵素の活性により、哺乳類の体細胞はDNA複製を経て同じメチル化状態を維持できる(図4)。またDNAメチル化が遺伝子発現の制御機構として働くことは、X染色体の不活性化をはじめ多くの例が示すとおりである。
インプリンティング遺伝子のメチル化状態を調べると、実際に父性・母性対立遺伝子の間に差が見られる。さらにDnmt1をノックアウトしたマウスの体細胞で、3つの遺伝子のインプリンティングが変化したことから、メチル化のインプリンティングへの関与が明確になった。DNAメチル化はヒストン蛋白質の修飾などのエピジェネティックな機構と協調してインプリンティングを制御すると考えられている。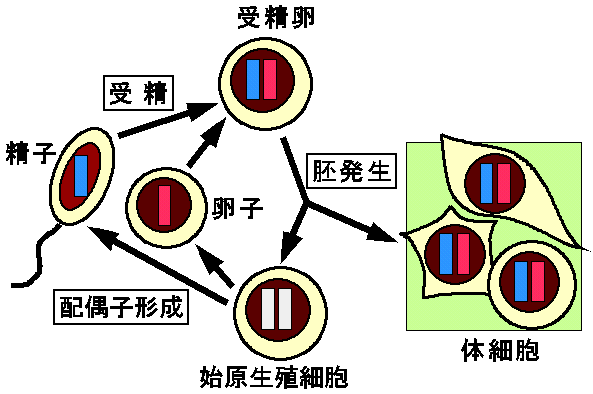
図3:インプリンティングのサイクルを示した模式図。
ここでは精子(父親)由来か卵子(母親)由来かのインプリントを異なるパターン(色)で示す。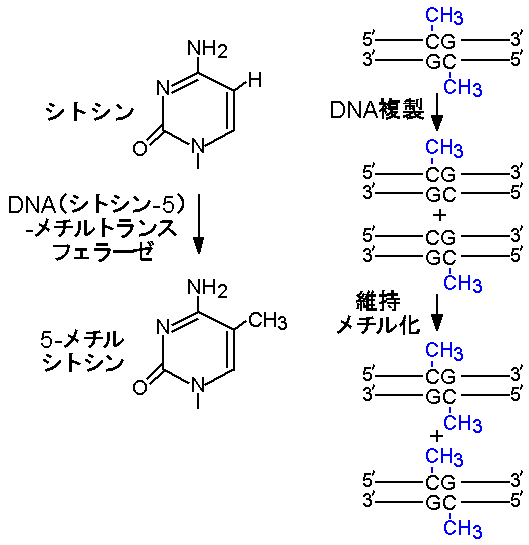
図4:シトシンのメチル化(左)と維持メチル化(右)。
佐々木裕之:「現代医学の基礎第5巻,生殖と発生」(岩波書店)第9章に加筆(文責:佐々木裕之)
- インプリンティングと生殖細胞
インプリンティングの最初の段階は、雌雄の配偶子形成過程で父親由来、母親由来のインプリントが刷り込まれることである(図3)。配偶子形成途中の生殖細胞が父親型・母親型のインプリントを獲得しているかどうかは、核移植や顕微受精の技術でこれらの細胞の核と未受精卵の核を組み合わせ、それらの発生能を調べると推定できる。このような研究から、母親型インプリントのかなりの部分が卵形成過程のうち第一減数分裂前期の卵成長期(一次卵母細胞)に獲得されることがわかった。また父親型インプリントは精子形成過程の減数分裂以前に刷り込まれている。
一方、初期の発生過程で生殖系列に入った細胞では、新たな刷り込みが起こる前に両親由来のインプリントが消去される(図3)。では始原生殖細胞はどの時期までインプリントを保持し、どの時期に消去または書き換えが始まるのだろうか?8.0~8.5日齢胚の移動期の始原生殖細胞から樹立されたEG(embryonic germ)細胞は、正常胚とキメラを形成する能力を持ち、正常な全分化能を示す。これは移動期の始原生殖細胞がインプリントを保持していることを示唆する。しかし11.5?12.5日齢胚の始原生殖細胞から樹立したEG細胞は、キメラ形成実験において異常な表現型を示し、すでにインプリントの消去または書き換えが始まっている。したがって始原生殖細胞が生殖隆起に達し、性分化が始まるころには、新たなサイクルに入ると考えられる。
2004年、国立遺伝研の佐々木研究室は、Dnmt3aと呼ばれるメチルトランスフェラーゼをノックアウトしたマウスの解析結果から、この酵素が雌雄の配偶子形成過程で父親型・母親型のインプリントを刷り込んでいると結論した(Kaneda et al. Nature 429, 900-903(2004))。Dnmt3aは非メチル化状態のDNAに新たなメチル化を導入する活性をもつことから、精子・卵子から受精を経て伝達されるインプリントの正体はDNAメチル化であることが確実となった。このように、インプリンティングの機構が少しずつ明らかになりつつあるが、どうして雌雄の配偶子形成過程で異なるインプリントが生じるのか(つまり、どのようにして異なる遺伝子群がメチル化されるのか)は未だ不明である。佐々木裕之:「現代医学の基礎第5巻、生殖と発生」(岩波書店)第9章に加筆(文責:佐々木裕之)
- インプリンティングの関与するヒトの先天異常
胞状奇胎(雄核発生)や卵巣奇形腫(単為発生)以外にもヒトのインプリンティング関連疾患が知られている。Prader-Willi症候群(PWS)とAngelman症候群(AS)はともに精神発達遅滞があり、加えて前者には肥満や筋緊張低下、後者には失調歩行や発作的笑いなどの症状がある。両者とも15q11‐13領域に異常があり、PWSでは父由来欠失または母性ダイソミー、ASでは母由来欠失または父性ダイソミーが認められる。Beckwith-Wiedemann症候群(BWS)は臍ヘルニア、過成長、内臓肥大、腫瘍の合併を特徴とし、11p15.5領域(マウスの第7染色体遠位部に相当)の父性トリソミー、父性ダイソミーなどが認められる。またWilms腫瘍などのがんでもインプリンティングの関与が疑われている。
佐々木裕之:「現代医学の基礎第5巻,生殖と発生」(岩波書店)第9章より引用

