間期核の構造と機能
- はじめに
近年の顕微鏡観察技術や画像処理法などの進展により、間期の核は、高度に組織化され、たくさんの核内小器官や構造体などの区画化を含んだ動的な構造体であることがわかってきました。この章では、間期核の組織化とその機能について概説します。
文責:西嶋仁、柴原慶一
- 染色体はどのようにして核内に配置されるのか
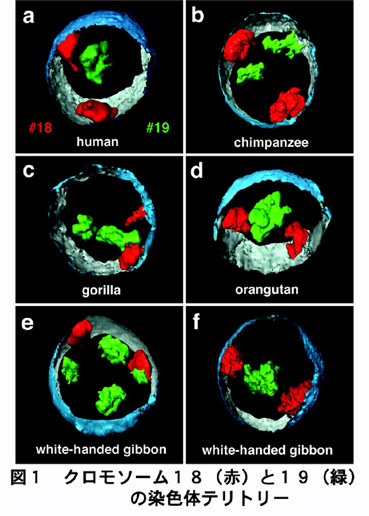 間期核における染色体の存在様式については、1903年にTheodorBoveriが馬回虫の分裂を詳細に観察することで、「染色体テリトリー」というモデルを提唱しました。しかしこのモデルが支持され続けてきた訳ではなく、間期の染色体が核内で区画化された構造体として電子顕微鏡下で観察されないことから、間期の染色体はむしろほどけたクロマチン繊維が入り混じった状態で存在していると推定されていました。1984年になってCremerらは、分裂中期の染色体のUV損傷部位が娘細胞の間期核内においても一定の領域をもつことを観察し、「染色体テリトリー」仮説を実験的に再証明しました1)。最近では、蛍光in situハイブリダイゼーション法(FISH)や免疫細胞化学を利用した、高度な画像処理法によって間期核の3次元像の再構築が行われており、間期核における染色体は高度に区画化されていて互いに混ざり合うことがないドメイン構造(染色体テリトリー)をとっていることが理解されるようになりました(図1)2)。この染色体テリトリーの核内配置には一定の規則性(染色体サイズや遺伝子密度に関連)があり、進化的にも保存されたものであろうと考えられています。しかし、個々の染色体のテリトリーがどのようにして維持されているのかはまだ明らかにされていません。
間期核における染色体の存在様式については、1903年にTheodorBoveriが馬回虫の分裂を詳細に観察することで、「染色体テリトリー」というモデルを提唱しました。しかしこのモデルが支持され続けてきた訳ではなく、間期の染色体が核内で区画化された構造体として電子顕微鏡下で観察されないことから、間期の染色体はむしろほどけたクロマチン繊維が入り混じった状態で存在していると推定されていました。1984年になってCremerらは、分裂中期の染色体のUV損傷部位が娘細胞の間期核内においても一定の領域をもつことを観察し、「染色体テリトリー」仮説を実験的に再証明しました1)。最近では、蛍光in situハイブリダイゼーション法(FISH)や免疫細胞化学を利用した、高度な画像処理法によって間期核の3次元像の再構築が行われており、間期核における染色体は高度に区画化されていて互いに混ざり合うことがないドメイン構造(染色体テリトリー)をとっていることが理解されるようになりました(図1)2)。この染色体テリトリーの核内配置には一定の規則性(染色体サイズや遺伝子密度に関連)があり、進化的にも保存されたものであろうと考えられています。しかし、個々の染色体のテリトリーがどのようにして維持されているのかはまだ明らかにされていません。
文責:西嶋仁、柴原慶一
- 転写や複製は核内のどこで行なわれるのでしょうか
核内のどこで複製や転写が行なわれているかは、標識された前駆体を用いて、それぞれ新規に合成されたDNAと新規に転写されたRNAを標識することで観察することができます。S期の異なった時期に異なった染色体の領域のDNAが複製され、複製サイトの分布はS期が進行するにつれて変化することが知られています。最も早い時期に複製される部位は転写が活性な領域であると考えられていて、複製フォーサイは核の内部全体にわたる数百の小さな部位として観察されます。S期中期では、核表面にやや大きな複製フォーサイが観察され、さらにS期後期になると、核の内部および周辺に数少ない大きな複製フォーサイが観察されるようになります(図2)3)。
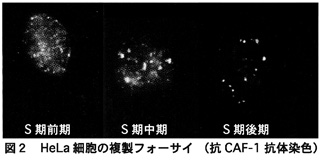
こういった複製フォーサイは電子顕微鏡画像においても高密度な集合体として観察され、複製フォーサイには複製されたDNAのみならず、DNA複製に必要とされる多くの因子群が局在し、いわゆる「複製ファクトリー」が形成されると考えられています。
転写部位も複製部位と同様に核内全域で多数のフォーサイとして観察されますが、転写部位は複製フォーサイとは別の部位として識別されます。転写には主に3つのRNAポリメラーゼが関与していて、RNAポリメラーゼIはリボソームRNAの転写に関与するため、この酵素により仲介される転写サイトは必ず核小体の内部にあります。RNAポリメラーゼIIはほとんどの遺伝子の転写に関与し、RNAポリメラーゼIIIは5SrRNAとtRNAを転写するので、これらの活性部位は核の全域にわたる数千箇所の領域で観察されます。mRNA前駆体のスプライシングは転写とカップルしているとも考えられていて、転写部位はスプライシング因子群を含むスプライシング因子区画と呼ばれる別のフォーサイと隣接しています。形態学的には、スプライシング因子区画は後ほど述べるクロマチン間顆粒とクロマチン周囲繊維に対応しています。文責:西嶋仁、柴原慶一
- 核マトリクスとは
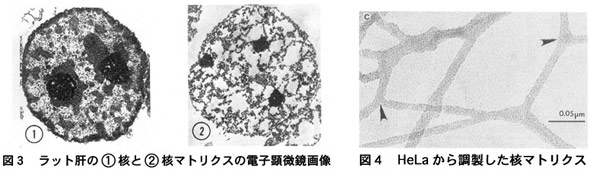
間期核内に、DNAと可溶化タンパク質を除去した後にも難溶性残存物があることが1948年Zbarskiiらによって初めて報告されました。生化学的に分離可能なこの画分は1974年にBerezney & Coffeyによって「nuclear matrix:核マトリクス」と命名され、電子顕微鏡による観察の結果、核内においても細胞質内と同様に、網状、フィラメント状の骨格構造が存在している可能性が示唆されました(図3、4)4)、5)。DNA複製や転写が盛んに行なわれる部位も、この難容性残存物である核内構造(核マトリクス)に固く付着していると考えられています6)。次項で記載するように、間期の細胞核は高度に組織化され、多種多様な特異的機能を有するnuclear domain(核ドメイン)が存在することが判明しており、核マトリクスがそのような構造体を形成するための足場を提供していると考える研究者も少なくありません。核マトリクスの実像と機能は未解明のままであり、今後の研究の進展が期待される分野です。
染色体スキャフォールドとの関係
分裂期の染色体もスキャフォールドと呼ばれるコア構造を基盤としており、その主要な構成要素であるトポイソメラーゼIIaとコンデンシンがスキャフォールド付着領域(SAR)と呼ばれるDNA領域と結合し、クロマチンをループ状にまとめていると考えられています7)。トポイソメラーゼIIaは間期核マトリクスの構成因子でもあり、また、SARも間期において核マトリクスに結合しているDNA領域(MAR)と同一のものであることから、間期核における核内マトリクスと分裂期の染色体スキャフォールドとの間の相互の関係が注目されます。
文責:西嶋仁、柴原慶一
- その他の核構造
間期核にはその主要な構成要素である、クロマチン、核膜、核マトリクスに加え、様々な核内小器官や核内構造体がひしめき合っています(図5)。この項では、主立った核内小器官や核内構造体について概説します。
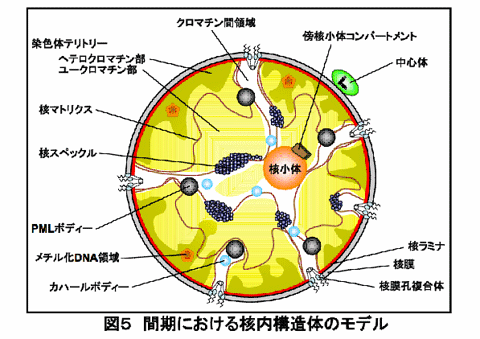
(1)核小体
核小体は真核細胞の核内にある最も大きくて目立つ核内小器官であり、1781年にFontanaによって発見されました。核小体はリボソーム合成の中心的構造体であり、多コピーのリボソーム遺伝子(rDNA)の存在する領域(NOR;nucleolar organizer region:仁形成部位)が局在しています。核小体は細胞周期進行において分裂期前期には消失しますが、間期にはrDNAからの転写とともに再形成されます8)。ヒトでは13、14、15、21、22番染色体短腕に存在する活性化rDNAに形成されたmini-核小体が、間期の間に融合を重ねて、大きな核小体が構築されます。間期の核小体は、繊維中心(FCs)、高密度繊維成分(DFC)、顆粒成分(GC)の3つの異なる対照的な構造体から構成されていますが、核小体のどの場所でどういった基本的なプロセスが行なわれるのかについてはまだ理解が進んでいません。
クロマチン周囲繊維とクロマチン間顆粒(核スペックル)
クロマチン周囲繊維はクロマチンで新たに合成されたRNAを含む領域であり、クロマチン間顆粒はリボ核タンパク質からなるクロマチン間顆粒クラスター(IGC)と呼ばれる不規則な顆粒群を形成する区画です。光学顕微鏡でクロマチン周囲繊維とIGCを区別することは難しく、まとめてスプライシング因子区画と呼ばれることもあります9)。
カハールボディー(コイルドボディー)
カハールボディーは1903年にR. Cajalによって発見された直径0.2mmから2mmの構造体で、ひとつの間期核には1つもしくは少数のカハールボディーが存在します。カハールボディーの顕著な特徴はコイリンと呼ばれる約80kDaのタンパク質を含むことですが、その他にも、RNAポリメラーゼとRNAのプロセッシングに必要な様々な因子群や、低分子リボ核タンパク室(snRNP)や核小体低分子リボタンパク質(snoRNP)を含んでいます。カハールボディーの詳細な機能はまだ理解されていませんが、少なくともsnRNPやsnoRNPの分別と方向付けに欠かせない構造体であろうと推定されています。
PML体(前骨髄性白血病構造体)
PML体は、PMLタンパク質を含む外層、およびPMLタンパク質を含まない内部コアよりなる直径約0.5mmの核内構造体です。この核内構造体はPMLタンパク質が中核となって形成されているので、染色体転座によりPMLタンパク質が変異した急性前骨髄性の白血病細胞ではPML体は崩壊しています。レチノイン酸療法を行うとPML体が再形成されて病態が寛解します。PML体の機能に関しては理解されていない部分が多いのですが、細胞周期の制御とアポトーシスに関係していると示唆する報告もあります。
参考文献
Cremer T., et al. (1984). chromosome today 8, 203-212.
Tanabe H., et al. (2002). Proc Natl Acad Sci U S A. 99, 4424?4429.
Shibahara K-i., & Stillman B. (1999). Cell 96, 575-585.
Berezney R., & Coffey D. (1974). Biochem Biophys Res Commun. 60, 1410-1417.
He D., et al. (1990). J Cell Biol. 110, 569-580.
Berezney (2002). Adv Enzyme Regul. 42, 39-52.
Maeshima K., & Laemmli U. (2003). Dev Cell. 4, 467-480.
Roussel P., et al. (1996). J Cell Biol. 133, 235-246.
Misteli, T. (2000). J.Cell Sci 113, 1841-1849.文責:西嶋仁、柴原慶一
染色体分配とは
- 染色体分配とは?
- わたしたち人間を含む生き物の細胞には、遺伝子が記録されたDNAが入っています。たくさんの遺伝子が書き込まれた1本のDNAは、細胞の中で折り畳まれ、染色体と呼ばれる構造を取っています。細胞が分裂して増えるときに、この染色体は2つにコピーされます。このコピーされた染色体を子孫の細胞に受け渡すことが染色体分配です(図1)。
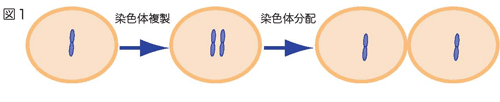
原図、資料:波田野俊之
- 分配をおこなうそのしくみは?
生き物の細胞、植物や私たちを含む動物の細胞では、およそ次のようなしくみで染色体は分配されています。
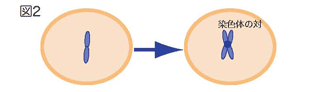
- まず、染色体は2つがコピーされ、コピーされた2つの染色体は対になってつなぎ止められます。この対になった2つの染色体は、姉妹染色分体と呼ばれます(図2)。
- 姉妹染色分体に向かって、細胞の特定の部分にある中心体(緑丸)という構造物から、糸が伸びていきます。この糸は、姉妹染色体上のセントロメアと呼ばれる部分につながり、紡錘体と呼ばれる構造ができます(図3)。
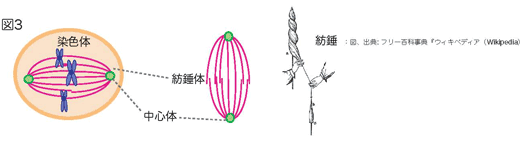
紡錘とは、糸を紡ぐときに使う糸を巻き付ける道具のことで、この道具と形が似ています(図3右)。この紡錘体を形成する紡錘糸は微小管という繊維で出来ています(図4)。この微小管は、チューブリンというタンパク質がつながって筒状に並んで出来ています(図4)。
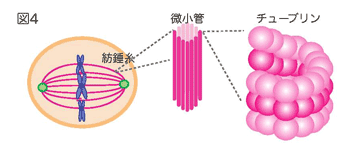
- 姉妹染色分体の対が、紡錘体構造によって細胞の中央に整列します(図4)。このとき、染色体の数がきちんとそろっているかなど、姉妹染色分体に異常がないかを確かめます。
- 細胞の中央で染色体DNAのペアは別々に分けられ、中心体の方向へ移動します(図5)。その後、細胞が分裂し、それぞれの子供の細胞に染色体は分配されます。
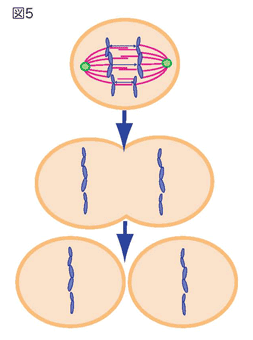
このように、私たちを含む生き物の細胞の染色体DNAは、大掛かりで複雑な仕組みで、子孫の細胞に伝えられて行きます。
原図、資料:波田野俊之
- まず、染色体は2つがコピーされ、コピーされた2つの染色体は対になってつなぎ止められます。この対になった2つの染色体は、姉妹染色分体と呼ばれます(図2)。
- バクテリアの染色体の分配
たち動物や植物にくらべてはるかに小さなバクテリアでも、染色体は正しく子孫に受け渡されます。全長1?2μmの小さなバクテリアには、紡錘体のようなものは見当たらず、染色体分配の仕組みはほとんど判っていません。
バクテリアの染色体は、私たちの細胞と異なり、コピーされた部分から順番に分配されていきます。- バクテリアの染色体は、複製開始起点(oriC 図5、赤丸)と呼ばれる特定の場所からコピーされていきます。このコピーは、複製と呼ばれていて、バクテリアの真ん中にある複製装置(図5、オレンジ)によって行われます。
- (2)複製開始起点(oriC)は、コピーされるとすぐに細胞の両端の方へ移動していきます(図5、矢印A)。
- (3)次にコピーされた染色体の部分も、両端に移動していきます。移動した先で、染色体は折り畳まれていきます(図5、矢印B)。
- (4)細胞が分裂する前に、全ての染色体のコピーが終了し、二つの新しい細胞の中でそれぞれ新しい染色体の構造が作られます(図5、矢印C)。
このようにして、バクテリアは独特のしくみで、染色体DNAを分配しています。
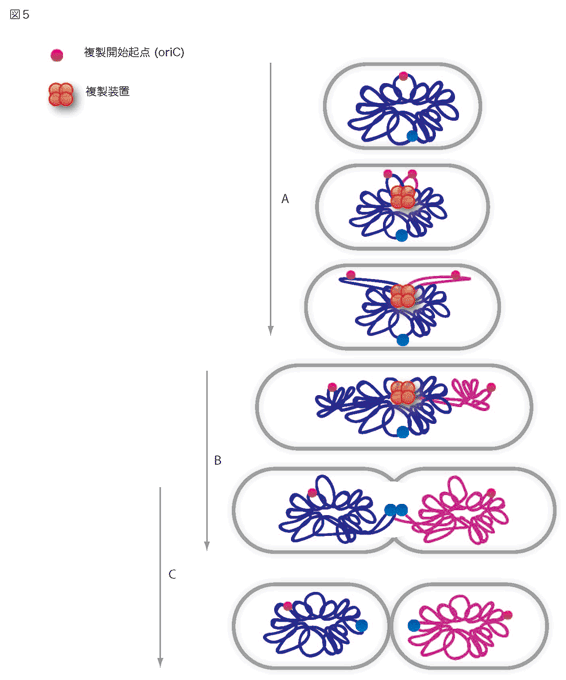
最近、複製開始起点の移動に必要な、染色体DNA上のある特定の配列が発見され、バクテリアのセントロメアではないかと注目されています。又、複製された染色体DNAを折り畳むタンパク質も見つかっています。これらの発見をきっかけに、バクテリアの染色体分配のしくみが明らかになると期待されています。
原図、資料:波田野俊之
セントロメア
- はじめに
- 染色体とは、生物の設計図である全ゲノム情報を含んだ構造体です。生物にとって、染色体が正確に複製、分配されて安定に次世代細胞へと受け継がれていくことは、最も基本的な性質です(図1)。この染色体の分配過程に異常がおきると、遺伝情報の不正確な伝達を導き、がん化を始めとする細胞への悪影響が引き起こされます。したがって、染色体複製や分配の分子機構を解明することは、基礎生物学的および医学的両面から大切であると考えられます。
原図、資料:波田野俊之
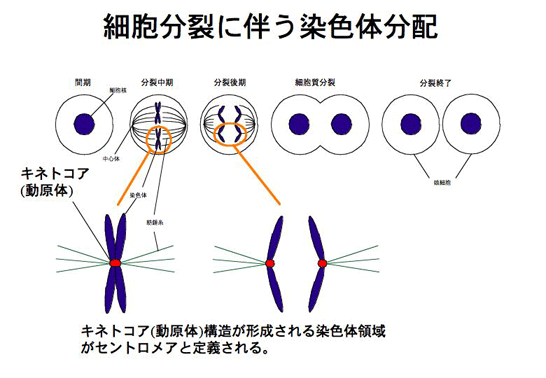
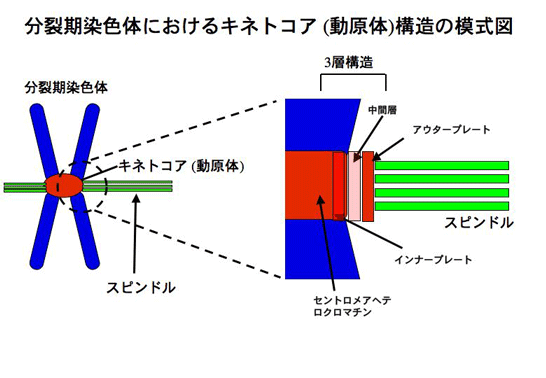
- 染色体分配に必須なセントロメア
- 細胞周期のS期で複製された染色体は、M期では両極から伸びた紡錘体に捕えられ、娘細胞へと分配されます。この際、紡錘体が結合する染色体の特殊構造はキネトコア(動原体)と呼ばれています。動原体が形成される領域が、セントロメアという言葉で定義されており、その領域に存在するDNAと複数のタンパク質から構成されています(図2)。上に述べたように、セントロメアと紡錘体の結合に異常がおこると、染色体の分配異常が誘発されます。したがって、染色体分配機構を理解するためには、セントロメアがどのように構築され機能するのかを知らなければなりません。しかしながら、高等動物細胞のセントロメア構造の分子基盤の解明はそれほど進んでいませんでした。セントロメアがMbpを超える長大なDNA領域と100種類程度の分子種からなる複雑な巨大複合体を形成していることが解明を遅れていた原因であったと予想されています。しかしながら、現在では、国内外の多くの研究者が、その巨大複合体の解明を目指して、センロメアを構成するゲノムDNAの実体やそこに存在するタンパク質分子種の同定や解析を行い、近年多くの知識が蓄積してきました。以下に現在までにわかってきた知見を解説します。
文責、資料:深川竜郎
- 動原体を形成するセントロメアDNA
- 動原体は、線虫などある種の生物を除いて通常、染色体の一部の領域に形成されます。動原体を形成する特殊領域として機能するためにDNA配列はどの程度関与しているのでしょうか?出芽酵母Saccharomyces cerevisiaeでは、セントロメアの分子構築がかなり明らかになっています。出芽酵母のセントロメアDNAはCDEI、 CDEII、CDEIIIと呼ばれる合計125bpのDNAから構成され(1)、CDEIIIに点変異が入るだけでセントロメアとして機能しなくなります。わずか125bpの長さでありますが、セントロメアDNAとしての機能発現には、DNAの一次配列が大きく関わっています。それに対して、高等動物のセントロメアDNA領域は、サテライトDNAを主成分とする繰り返しDNA配列がMbpのレベルで存在していることが明らかになっています(2)。サテライトDNAが機能的なセントロメア配列であるか否かについては、多くの論争があります。オーストラリアの研究グループはネオセントロメアとよばれる現象をヒト染色体から見いだしました(3)。すなわち、本来セントロメアとは無関係なユークロマチンの領域が、 何らかの機構で活性化されてセントロメアとして機能している染色体を同定したのです。このネオセントロメアのDNA領域を詳細に解析した結果、DNAの一次配列はユークロマチンとして機能する場合もセントロメアとして機能する場合も完全に同一であり、特殊な配列の取り込みなどは見いだせていません。このことは、どのような配列でも機能的なセントロメア配列に成りうる可能性を示唆しています。 一方, 他の研究グループは、人工的にセントロメアを構成する実験系を構築し, サテライトDNAが効率的に人工セントロメアを形成することを報告しています。また, 正常なヒトやマウスの染色体のセントロメア領域を観察すると, すべての染色体に共通してサテライトDNAの反復配列が存在しています。 この立場の研究者からすると、 ネオセントロメアのほうがむしろ例外であるとも考えられ、サテライトDNAこそが、機能的なセントロメア配列とも言えます。これまでの研究報告を総合的に考慮すると、「サテライトDNAはセントロメア形成に非常に有利に働くが, サテライトDNAがなくてもセントロメアが形成されることが稀に起きる」と解釈すると理解しやすいと思われます。
文責、資料:深川竜郎
- 高等動物の動原体を構成するタンパク質
- 高等動物の機能的なセントロメアDNAの実体については論争がありますが、通常のセントロメアもネオセントロメアでも、セントロメアDNAがCENP-AというヒストンH3のバリアントを特異的にセントロメアのクロマチン領域に取り込むことが動原体形成のための引き金となっています。このことから考えて、CENP-Aを始めとする動原体構成タンパク質を分子レベルで同定してその機能を解明することが、染色体分配の制御機構を理解する上で重要であると言えます。
1980年にMoroiらは、ヒトの自己免疫疾患(強皮症)の患者の血清が、染色体のセントロメア領域を認識することを発見しました(4)。80年代後半から90年代の初頭において、本血清が認識する動原体構成タンパク質の同定が行なわれ、これらの血清は、主に3種類のタンパク質を認識していることが判明しました。それらは、CENntromere Protein A、B、Cと名付けられ、頭文字をとってCENP-A、CENP-B、CENP-Cとして呼ばれています。前述のようにCENP-Aは、分子量17kDaのヒストンH3様タンパク質であり、セントロメア領域を決定するための重要な分子であると考えられています。CENP-Bは、ヒトセントロメアDNAを構成するaサテライトやマウスセントロメアDNAを構成するマイナーサテライトDNAの繰り返し配列と特異的に結合するタンパク質です。CENP-Cは、酵母からヒトに至るまで配列が保存されたタンパク質であり、セントロメアの正常な構造形成に必須なタンパク質です。CENP-AおよびCENP-Cは、細胞周期を通じてセントロメアに存在することから構成的動原体タンパク質とよばれ、動原体形成の引き金となっています。最近では、動原体形成にはまだ多くの他のタンパク質の関与が必要であると考えられ、近年、構成的動原体タンパク質としては、CENP-H, -I, -K, -L, -M, -N, -O, -P, -Q, -R, -S, -T, -U/50 まで同定されています(5)。構成的動原体タンパク質が動原体の土台を形成した後に、Mis12複合体、Ndc80複合体と呼ばれるいくつかのタンパク質複合体がセントロメア領域に局在し、紡錘体と結合できる機能的な動原体構造が形成されます。今後は、紡錘体と動原体の正確な結合が制御する様々な分子機構の解明が課題です。
文責、資料:深川竜郎
- おわりに
- 最近の研究の進展に伴い、高等動物の動原体構築に関する知見は蓄積してきました。それに伴い臨床サンプルを用いた動原体タンパク質の解析が行われ、がん患者の癌部で非癌部にくらべ、CENP-AやCENP-Hが過剰に発現し、セントロメア以外の場所に局在する例が観察されています(6)。しかしながら、何故がん細胞で動原体タンパク質が過剰発現するのかについては、説明できない点も多くあり、動原体タンパク質の異常発現が、癌化の原因であるか結果であるかについては多くの議論があります。基礎生物学の視点から、各複合体の制御機構の解明を進め、動原体形成機構を理解することが「がん」の重要な生物学的特性の理解につながると考えられます。
引用文献
- Clarke, L. Centromeres of budding and fission yeasts. Trends Genet., 6: 150-154, 1990.
- Schueler, M.G., Higgins, A.W., Rudd, M.K., Gustashaw, K., and Willard, H.F. Genomic and genetic definition of a functional human centromere. Science, 294: 109-115, 2001.
- Choo, K.H. Domain organization at the centromere and neocentromere. Dev. Cell 1:165-177, 2001.
- Moroi, Y., Peebles, C., Fritzler, M.J., Steigerwald, J., and Tan, E.M. Autoantibody to centromere (kinetochore) in scleroderma sera. Proc. Natl. Acad. Sci. USA, 77: 1627-1631, 1980
- Cheeseman, I.M.and Desai, A. Molecular architecture of the kinetochore-microtubule interface. Nature Rev. Mol. Cell. Biol.9:33-46, 2008.
- Tomonaga, T., Matsushita, K., Ishibashi, M., Nezu, M., Shimada, H. et al. Centromere protein H is up-regulated in primary human colorectal cancer and its overexpression induces aneuploidy. Cancer Res., 65:4683-4689, 2005.
文責、資料:深川竜郎

