変異型HRAS形質転換細胞ではクロマチンが凝縮している
前島研究室・ゲノムダイナミクス研究室
黒川研究室・ゲノム進化研究室
工樂研究室・分子生命史研究室
Chromatin organization and behavior in HRAS-transformed mouse fibroblasts
Aoi Otsuka*, Katsuhiko Minami*, Koichi Higashi, Akane Kawaguchi, Sachiko Tamura, Satoru Ide, Michael J. Hendzel, Ken Kurokawa, Kazuhiro Maeshima#
* These authors equally contributed to this work. #corresponding author
Chromosoma 2024 Feb 24 DOI:10.1007/s00412-024-00817-x
高等真核生物細胞のゲノムDNAはヒストンに巻き付きヌクレオソームを形成しています。近年、超解像イメージングやゲノムの3次元構造解析技術の1つであるHi-C法によって、ヌクレオソームは不規則に折りたたまれ、いくつもの凝縮したクロマチンドメインを形成していることが明らかにされてきました。ドメイン内部で局所的に液体のように振る舞うクロマチンの挙動は、転写やDNA修復といった細胞機能と深くかかわっていることが分かってきています。では、しばしばこうした機能が亢進しているがん細胞で、クロマチンはどのように振る舞っているのでしょうか?
今回、情報・システム研究機構 国立遺伝学研究所 ゲノムダイナミクス研究室の大塚碧 総研大生(SOKENDAI特別研究員)、南克彦 総研大生(元SOKENDAI特別研究員、学振特別研究員 DC2)、井手聖 助教、田村佐知子 テクニカルスタッフ、前島一博 教授のグループ、ゲノム進化研究室 東光一 助教、黒川顕 教授のグループ、分子生命史研究室 川口茜 助教は、カナダ・アルバータ大学のMichael J. Hendzel教授と共同で、がん遺伝子であるRASにより形質転換 (がん化)した細胞はそうでない細胞に比べて、よりクロマチンが凝縮していることを発見しました。
本研究では、腫瘍性変異型RASで形質転換されたマウス細胞 (CIRAS-3細胞) と非形質転換細胞 (10T1/2細胞)を用い、様々なスケールでクロマチンの振る舞いの違いを調べました。まず、共焦点顕微鏡を用いて細胞核の体積を調べ、CIRAS-3細胞で核が縮小していることを見出しました。また、超解像蛍光顕微鏡を駆使して生きた細胞でヌクレオソームの動きを観察したところ、CIRAS-3細胞ではクロマチンの動きがより抑制されていることがわかりました。この細胞ではヘテロクロマチンが増加しており、さらにクロマチンの空間的相互作用をマッピングするin situ Hi-C法から、「Bコンパートメント」と呼ばれるヘテロクロマチン領域同士の相互作用が増加していることがわかりました。
今回明らかになった、変異型RAS形質転換細胞における核の縮小とクロマチンの凝縮は、がん細胞が転移する際の細胞核の変形によるDNAダメージを軽減し、がん細胞の転移に有利に働いていると考えられます(図)。
本研究は、日本学術振興会(JSPS) 科研費(21H02453, 23K17398, 23K05798, 22H05606, 21H02535, 23KJ0998)、学術変革領域 A「ゲノムモダリティ」(20H05936)、科学技術振興機構(JST) JST 次世代研究者挑戦的研究プログラム(JPMJSP2104)、内藤記念科学振興財団、武田科学振興財団の支援を受けました。ゲノム解析については、先進ゲノム支援(22H04925(PAGS))の一環としておこなわれました。
雑誌「Chromosoma」は1939年創刊の歴史ある染色体学術誌で、遺伝研の図書館には創刊号から揃っています。
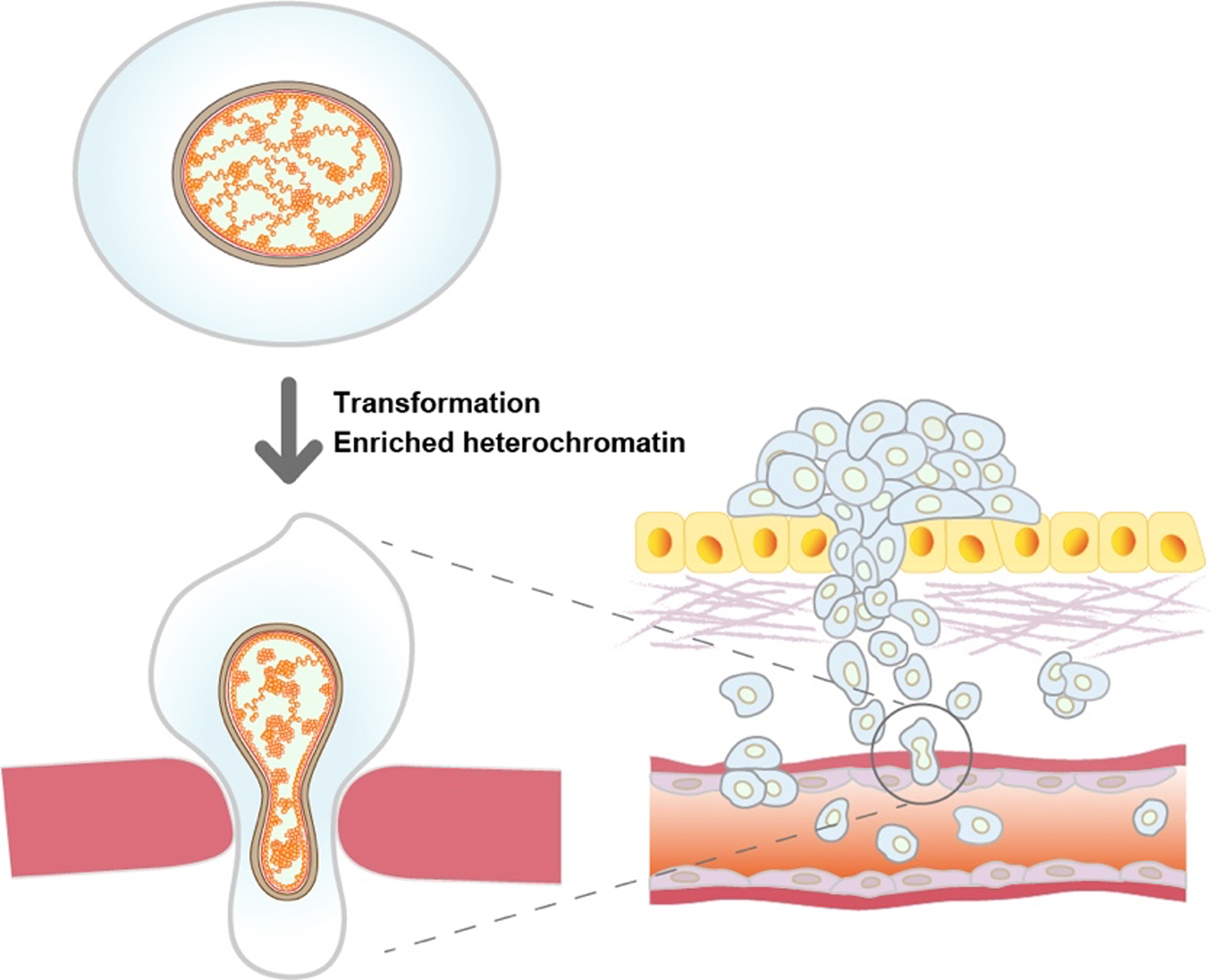
図:変異型HRAS形質転換細胞(左下)は、正常細胞(左上)に比べて凝縮したクロマチンを有している。凝縮したクロマチンは、細胞が転移する際の細胞核変形によるDNAダメージを軽減するのに役立つと考えられる。















